脑图:
在我们研究某种疾病的发病机制或者某种药物的作用靶点时,经常需要建立目的基因过表达或基因敲除的细胞模型,目前构建稳转细胞株及部分敲除细胞株最常用的方式之一是慢病毒法,慢病毒因其可以转染几乎所有种类的细胞,且在转染后可以整合到细胞的基因组而长期表达的优势,是目前较为主流的构建方法,但慢病毒构建的稳转细胞株相对于野生型没有生长优势;此外,慢病毒对目的基因的载量也有限。因此,寻找一种高效简便可替代慢病毒法的方法显得尤为重要。
转座子的出现为构建基因编辑细胞株提供了一个全新的视野。转座子也被称为跳跃基因,由Barbara McClintock教授在上世纪50年代发现,并于1983年因此发现而获得诺贝尔医学奖,是指一段DNA序列由基因组的一个位置跳跃到另一个位置。转座子主要包含两种类型:
☑ 一类转座子:逆转座子(retrotransposons),自身不表达转座酶,先转录为RNA,通过RNA的反转录获得cDNA,cDNA在整合酶的作用下转移到其他基因组位置。
☑ 二类转座子:DNA转座子(DNA transposons),通过自身编码的转座酶直接切割转座子所在DNA序列,实现序列的转移。在脊椎动物中发现的转座子系统中,以睡美人转座子(SleepingBeauty)和piggyBac转座子等DNA转座子最为常见。
睡美人转座子是由科学家Levis于1997年在脊椎动物中首个发现的转座子, 其通过生物信息学方法分析8种鲑鱼中12个Tc1类转座酶序列,找出了其中的保守序列,确定了已经灭绝的鲑鱼中具有活性的转座酶的基因序列,并称其为睡美人转座子。但睡美人转座子对宿主要求严格,且存在转座效率不稳定等情况,限制了其广泛应用,而piggyBac转座子则因其特异的整合位点、精密切割以及广泛存在的特性被大家所青睐。
PiggyBac转座子载体简介
PiggyBac转座子载体是一种常用于基因工程的工具,它属于DNA转座子的一种。PiggyBac转座子载体的特点在于其高效的转座能力和较低的宿主细胞毒性,使得它在基因克隆、基因表达调控、基因治疗等领域有着广泛的应用。
PiggyBac转座子载体的工作原理
PiggyBac转座子载体的工作原理是通过转座酶的催化,将含有特定基因的DNA片段从一个位置转移到另一个位置。这个过程不需要依赖于同源重组,因此转座效率相对较高。PiggyBac转座子载体可以将目标基因插入到宿主细胞的基因组中,或者从基因组中移除特定的基因片段。
PiggyBac转座子载体的应用实例
PiggyBac转座子载体在昆虫遗传学研究中有着重要的应用。例如,在苹果蠹蛾不育昆虫释放技术中,研究者们使用基于PiggyBac的质粒载体,插入显性条件致死基因以培育遗传性别品系,同时插入荧光蛋白等标记基因来显示转基因的效果。这种技术可以有效地控制苹果蠹蛾的种群数量,减少其对苹果树的危害。
PiggyBac转座子载体的优势与局限性
PiggyBac转座子载体的优势在于其高效的转座能力和较低的宿主细胞毒性,这使得它在基因工程中具有很高的实用价值。然而,PiggyBac转座子载体的局限性在于其转座范围相对较窄,可能不适用于所有类型的宿主细胞。此外,PiggyBac转座子载体的转座过程可能会导致宿主基因组的不稳定,因此在使用时需要谨慎考虑。
综上所述,PiggyBac转座子载体是一种强大的基因工程工具,它在许多领域都有着重要的应用。然而,在使用时也需要注意其潜在的局限性和风险。
深入研究
PiggyBac转座子载体在昆虫遗传学研究中具体是如何被应用的?
PiggyBac转座子载体在昆虫遗传学研究中的应用主要体现在其作为一个高效的基因转移工具,用于在昆虫体内插入外源基因。这种转座子载体具有几个显著优点,包括较高的转座效率、低毒性以及能够在宿主基因组中保持稳定的整合状态。
转座子载体的基本原理
PiggyBac转座子载体的工作原理是通过特定的酶介导,将包含目标基因的转座子从一个位置跳跃到另一个位置。这个过程通常涉及两个关键步骤:首先是转座子的切割和移动,其次是目标基因的整合到宿主基因组中。由于PiggyBac转座子载体不依赖于宿主细胞的修复机制,因此它可以在多种昆虫物种中有效工作,包括家蝇等模式昆虫。
在昆虫遗传学研究中的应用实例
在昆虫遗传学研究中,PiggyBac转座子载体被用来创建转基因昆虫模型,这些模型可以用于研究基因功能、疾病传播机制以及昆虫行为等方面。例如,研究人员可以通过将含有增强型绿色荧光蛋白(EGFP)基因的PiggyBac转座子载体注射到家蝇卵中,实现活体基因稳定表达,并对其进行验证,为开展家蝇基因功能的研究奠定基础。
应用的优势和局限性
PiggyBac转座子载体的应用优势在于其操作简便、转座效率高,且不会引起宿主基因组的大范围重组。然而,它也有一些局限性,例如转座子的随机整合可能导致不可预测的基因表达变化,以及长期稳定性可能受到挑战。
综上所述,PiggyBac转座子载体在昆虫遗传学研究中扮演着重要角色,它不仅提高了基因转移的效率,还为理解昆虫的复杂生物学特性提供了有力的工具。随着科学技术的不断进步,未来PiggyBac转座子载体的应用范围有望进一步扩大,为昆虫遗传学研究带来更多突破。
PiggyBac转座子载体相比其他DNA转座子有哪些独特的优点?
PiggyBac转座子载体具有一些独特的优点,使其在基因工程领域中成为一个重要工具。以下是一些主要优势:
- 低毒性:与许多其他类型的转座子载体相比,PiggyBac转座子载体对宿主细胞的毒性较低。这意味着它们可以在细胞中更安全地操作,减少对细胞的潜在损害。
- 高效的转座活性:PiggyBac转座子载体具有很高的转座效率,能够快速将基因片段插入到宿主基因组的多个位点。这种高效率使得研究人员能够迅速实现基因的敲入或敲除。
- 广泛的宿主范围:PiggyBac转座子载体可以在多种细胞类型中转座,包括哺乳动物细胞、昆虫细胞等。这为研究人员提供了更多的选择,以便在不同的生物模型中进行实验。
- 易于操作:PiggyBac转座子载体的操作相对简单,不需要复杂的步骤或特殊的设备。这降低了实验的难度,提高了实验的成功率。
- 可逆性:PiggyBac转座子载体的转座事件可以通过特定的方法逆转,恢复原始的基因组状态。这对于研究基因功能和疾病机制非常有用,因为它允许研究人员在实验结束后恢复正常的基因表达。
这些优点使得PiggyBac转座子载体在基因克隆、基因治疗、基因功能研究等领域具有广泛的应用前景。
PiggyBac转座子载体在基因治疗领域的应用有哪些案例或潜力?
PiggyBac转座子载体在基因治疗领域的应用案例
PiggyBac转座子载体是一种高效的基因传递工具,它在基因治疗领域展现出了巨大的潜力。以下是一些具体的应用案例:
- 遗传疾病治疗:PiggyBac转座子载体被用于治疗一系列遗传性疾病,包括肌肉萎缩症、杜氏肌营养不良症等。通过将正常的基因序列插入患者细胞内,可以纠正突变基因导致的疾病症状[1]。
- 癌症治疗:在癌症治疗方面,PiggyBac转座子载体可以用来传递抗癌基因或者抑制肿瘤生长的因子。这种方法已经在某些类型的癌症治疗中显示出了积极的效果[2]。
- 免疫系统调节:PiggyBac转座子载体还被用于增强免疫系统的功能,例如通过传递特定的基因来提高T细胞的活性,从而增强对癌细胞的攻击能力[3]。
PiggyBac转座子载体的潜在应用
除了上述已知的应用外,PiggyBac转座子载体在基因治疗领域还有很大的发展空间:
- 个性化医疗:随着基因组学的发展,未来可能能够根据每个人的遗传信息设计个性化的PiggyBac转座子载体,以更精确地治疗各种遗传性疾病[4]。
- 多基因治疗:许多复杂的疾病涉及多个基因的异常。PiggyBac转座子载体可能能够同时修改多个相关基因,为这些疾病的治疗提供新的策略[5]。
- 长期稳定表达:PiggyBac转座子载体具有长期稳定表达所传递基因的潜力,这对于需要持续治疗的疾病来说是非常有价值的[6]。
综上所述,PiggyBac转座子载体在基因治疗领域的应用前景广阔,不仅在现有的治疗方法上有所突破,而且在未来的研究中也有望带来更多创新的治疗策略。
PiggyBac转座子结构与机制
PiggyBac转座子(粉纹夜蛾)是一个2475bp长的可自主转移元件,两末端分别有一个由13bp和19bp的TIR序列组成的亚末端重复序列,两端TIR序列之间的间隔分别是3bp(5’端)和31bp(3’端),在两个亚末端重复序列之间,有一个1.8kb的开放阅读框,编码由594个氨基酸组成、分子量大小为64KD的PiggyBac转座酶。如下图所示:
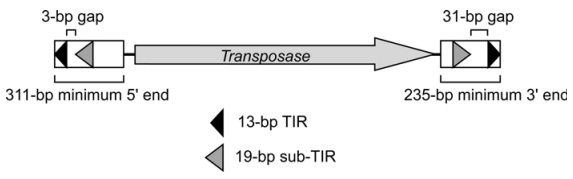
PiggyBac属于II类转座子,通过“剪切-粘贴”机制移动,即从基因组一个位置转座到另一个位置,不留下序列本身(与I类启动子通过“复制-粘贴”的移动方式不同)。
通过对PiggyBac超家族成员序列比对结果分析,发现PiggyBac转座酶保守的氨基酸位点为D268、D346和D447,与许多其它的转座酶和逆转录酶的保守结构域DDE类似,这三个位点参与了几乎所有的转座活动,包括DNA切割、发夹结构形成和目的序列的插入。具体的整合过程如下图所示:
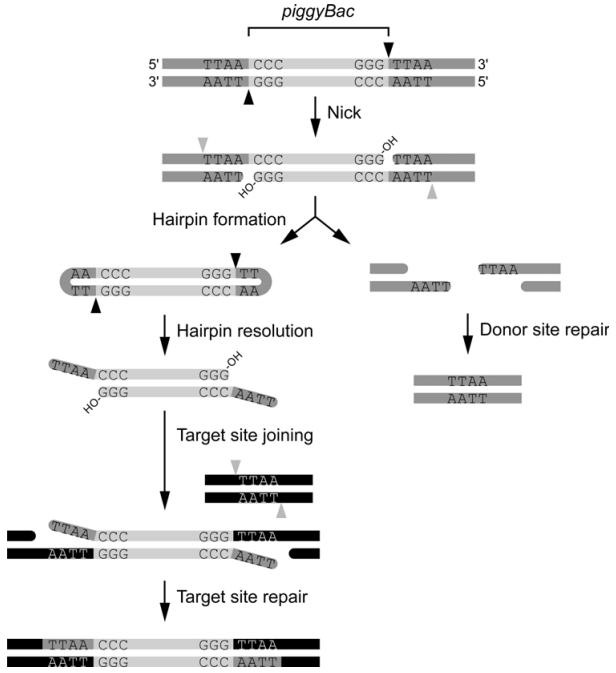
PiggyBac转座酶结合到转座子DNA序列两端,开始精确地切割每条DNA链转座子DNA的3’端,形成3’-OH结构;之后3’-OH攻击互补链5’末端TTAA与转座子间的磷酸二酯键,导致互补链DNA断裂,释放转座子,同时转座子两端形成发夹结构;找到新的TTAA四碱基整合位点后,转座酶伸展转座子的发夹结构,暴露3’-OH,同时3’-OH攻击TTAA整合位点的5’端,形成新的磷酸二酯键;互补链及转座子释放位点处的单链缺口的修复由宿主因子完成,转座完成。
PiggyBac转座子载体系统组成
PiggyBac转座子在发现后经过了一系列优化和改造的过程,如转座酶密码子优化,以及两端TIR序列的简化,最后形成了一套完整的PiggyBac载体系统。PiggyBac载体系统成员主要有:一个辅助质粒:编码转座酶;一个转座子质粒:含优化的两端亚末端反向重复序列,中间是被转座区域,可插入我们想转座到宿主基因组中的目的基因序列。
实验时需同时将辅助质粒和转座子质粒共同转化靶细胞,辅助质粒编码的转座酶识别转座子质粒两端的TIR序列并切割,释放的被转座区被转座酶整合到宿主基因组中含TTAA序列的位点,并在被转座区两端出现TTAA重复序列。
在不降低转座效率的情况下,两端优化后的TIR序列间可插入10kb左右的序列,研究表明,在小鼠中通过受精卵注射的方式,用PiggyBac转座子载体在基因组插入细菌人工染色体(BACs,150kb-300kb),转座效率最高的达到了45%(F0代中有45%的小鼠携带了BACs)。
应用
1. 作为非病毒载体
与传统的病毒载体相比,PiggyBac具有以下几大优点:首先是安全性高、操作方便(可直接用质粒转化细胞);其次是载体容量大(10kb-20kb),可实现多基因的共表达;第三是可通过调节转座子质粒和辅助质粒的比例,提高外源基因的整合效率,并且可通过反向PCR精确确定目的基因插入的位置;第四是再次转座后实现精确切离;第五是转座后不引起染色体重排等不稳定现象;最后是宿主范围广,转座效率高,较少依赖宿主因子。
2. 基因治疗
研究表明,PiggyBac转座系统在Hela、HEK293、CHO及H1299等细胞中高效转座,且携带的目的基因稳定表达,因而是很有吸引力的基因治疗候选载体之一。
3. 突变工具
PiggyBac再次转座偏向插入基因内部且插入位点分布较广,可用作基因插入突变的工具,这点为哺乳动物的基因组功能研究提供了较好的研究工具。
常用载体信息:
Super PiggyBac Transposase (PB200PA-1)
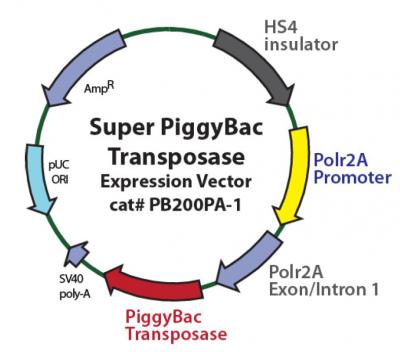
基本信息
质粒名称:Super PiggyBac Transposase (PB200PA-1)
出品公司:SBI
质粒别称:Super PiggyBac Transposase Expression Vector
质粒类型:PiggyBac转座子系统
启动子:rPolr2A
载体抗性:Ampicillin (氨苄青霉素)
载体介绍
Super PiggyBac Transposase Expression Vector。
Super PiggyBac Transposase (PB200PA-1),需与PiggyBac Dual promoter (PB-CMV-MCS-EF1α-GreenPuro;PB513B-1) 配套使用。
如下:
Super PiggyBac Transposase (PB200PA1)转座酶表达质粒
PiggyBac Dual Promoter PB513B-1插入基因的骨架质粒
PB220PA-1(Excision only PiggyBac transposase)切除转座子质粒
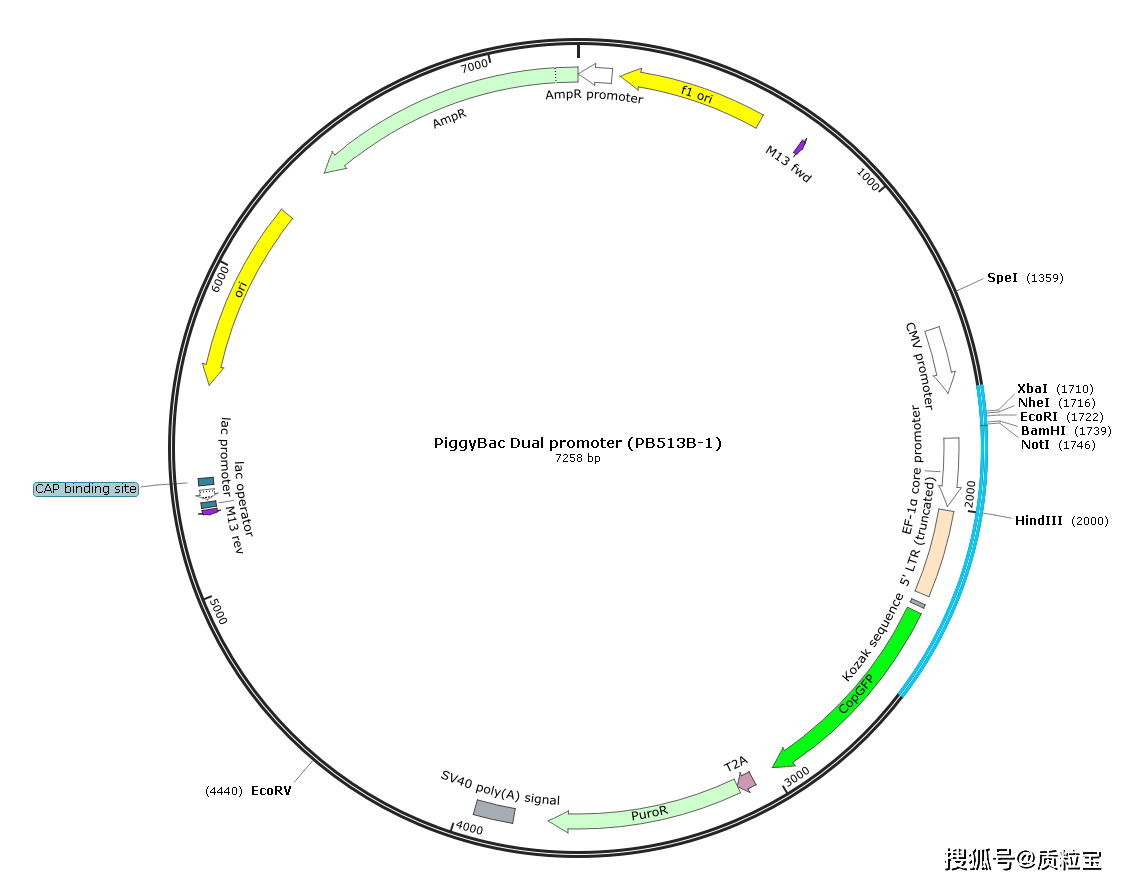
[^质粒信息]: 1-PB513B-1(PiggyBac Dual promoter) Map
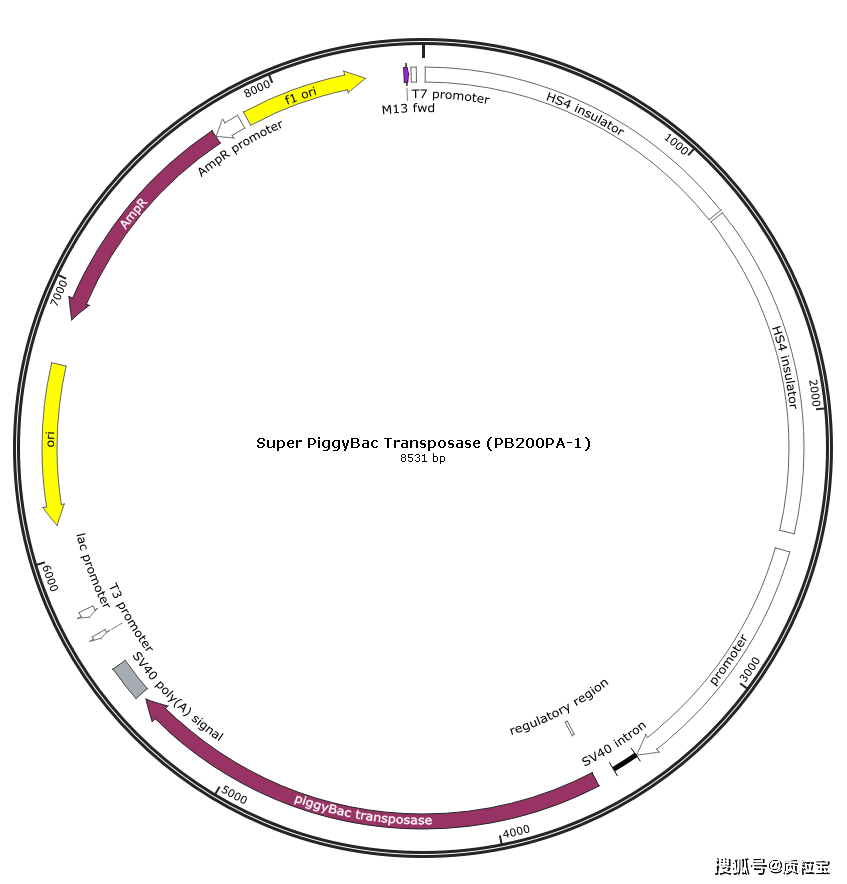
[^质粒信息]: 2-Super PiggyBac Transposase (PB200PA-1) Map
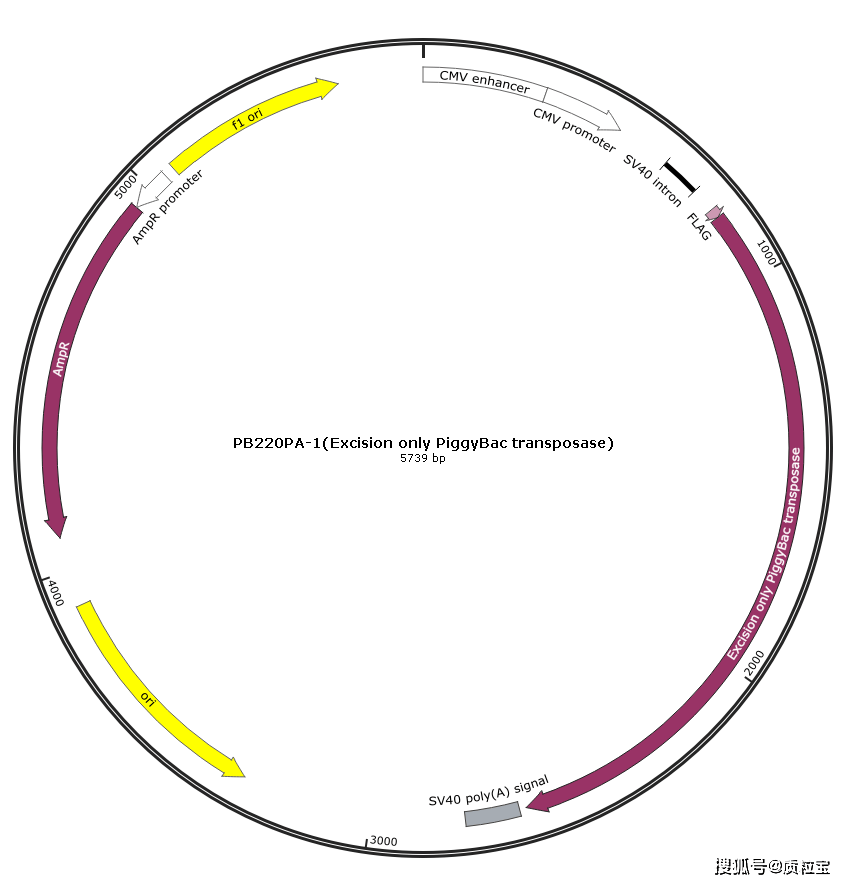
[^质粒信息]: 3-PB220PA-1(Excision only PiggyBac transposase) Map
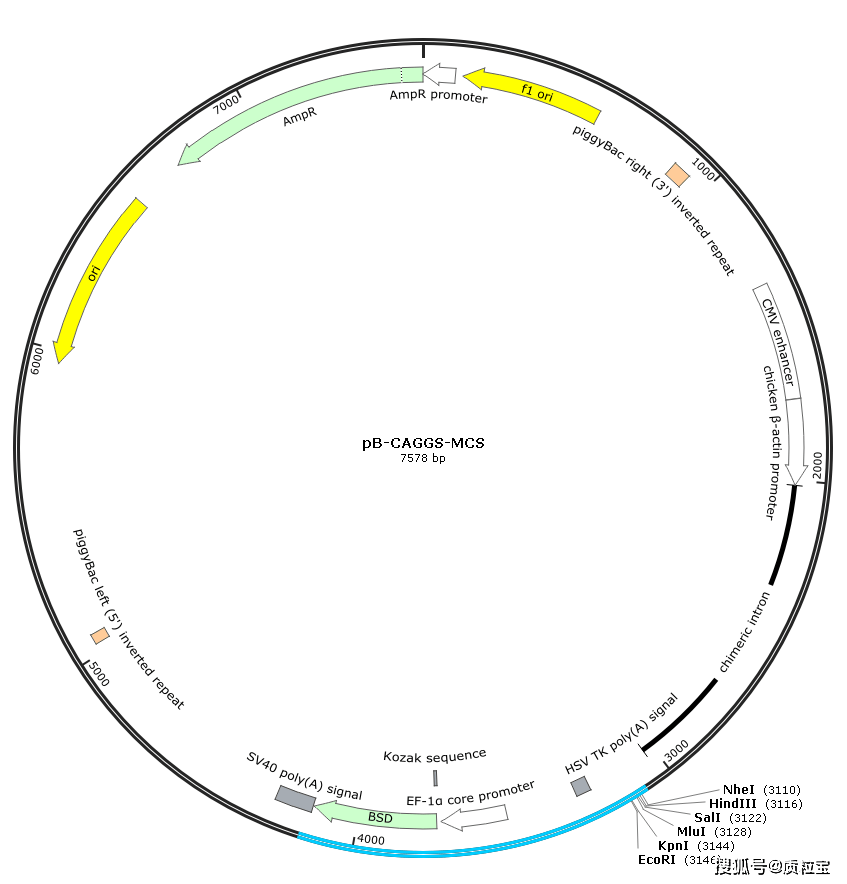
[^质粒信息]: pB-CAGGS-MCS-BSD Map
[^质粒信息]: PB-TetOne-HA-FLAG-P2A-EGFP-puro Map
[^质粒信息]: PB-TetOne-MCS-Hygro Map
[^质粒信息]: PB-TetOne-MCS-P2A-EGFP-puro Map
[^质粒信息]: PB-TetOne-MCS-puro Map
酶促生产的 piggyBac 转座子载体,用于高效非病毒制造 CD19 特异性 CAR T 细胞
piggyBac 转座子系统为经济高效且简单的嵌合抗原受体 (CAR) T 细胞生产提供了一种非病毒替代方案。临床级 CAR T 细胞的生成需要严格遵守当前的良好生产规范 (cGMP) 标准。不幸的是,常用慢病毒或逆转录病毒载体的高成本限制了许多非商业学术机构临床级 CAR T 细胞的制造。在这里,我们提出了一个制造平台,基于线性 DNA 转座子和编码 piggyBac 转座酶的 mRNA 的共电穿孔,高效生成 CD19 特异性 CAR T 细胞(CAR19 T 细胞)。转座子是在体外酶法制备的通过 PCR,包含侧翼为 piggyBac 3’ 和 5’ 臂的 CAR 转基因。mRNA 通过体外转录类似地制备。CAR19 T 细胞在细胞因子白介素 (IL)-4、IL-7 和 IL-21 的组合中扩增,以防止 CAR T 细胞的终末分化。载体拷贝数(VCN)的精确控制是通过降低转座子DNA的浓度来实现的,该程序每电穿孔1×10 7 个外周血单核细胞(PBMC)后可产生高达1×10 8 个CAR19 T细胞。体外21天文化。生产的细胞含有 >60% 的 CAR+ 细胞,VCN < 3。总而言之,所描述的制造平台实现了直接的 cGMP 认证,因为转座子和转座酶是通过酶合成在体外非生物产生的。适用于高实验性、早期阶段CAR T细胞产品的高性价比生产。
参考链接:
参考链接:
- 三种方法对草地贪夜蛾基因组转座子的注释
- CRISPR相关转座元件的研究及应用进展
- 猪诱导多能干细胞 (iPS)嵌合胚胎的制备
- 转基因在苹果蠹蛾不育昆虫释放技术中的应用
- piRNA的形成及其在雌性动物中生物学功能研究进展
- 精准高效外源 DNA 整合技术研究进展
- 艾美耳球虫转基因技术研究进展
- 猪基因组结构变异研究进展
- 蚕桑特色课程教学改革的思考–以“蚕桑生物技术”为例
- 大动物多能干细胞建立研究进展
- 功能基因筛选和鉴定策略的研究进展及其优缺点
- 显微注射法制备转基因家蝇技术的建立
- 抗原表位研究方法进展
- Advantages, disadvantages and research progress on strategies for screening and identifying functional genes
-
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/06/03/Piggybac转座子载体小传/
- 版权声明: 转载请注明出处,谢谢。

