[TOC]
来源:诺为生物
人体呼吸道上皮细胞
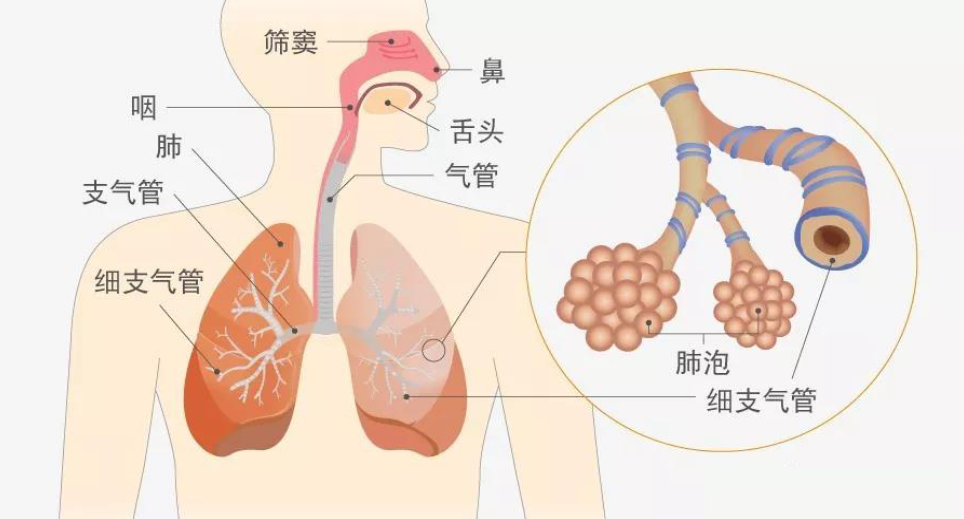
人类在呼吸过程中,吸入外界空气,空气中的氧气通过呼吸进入循环系统,同时体内细胞产生的二氧化碳通过肺泡和毛细血管的气体交换排到 外界空气中。呼吸道具有加温、湿润、过滤等保护功能。在换气前,呼吸道会将吸入的空气变暖,变湿,然后温暖湿润的空气将会直达肺部的最远端,同时可以保护肺部免受病原体及大气污染物的侵袭。人体呼吸道可分为传导区和呼吸区。
传导区包括鼻腔通道、气管、主支气管、肺内支气管 和细支气管,不参与换气流程。从气管到未端细支气管,随着呼吸道的不断分支,各级分支的直径和长度逐步缩小缩短。呼吸区包括呼吸性细支气管、肺泡管和肺泡囊。呼吸区是指肺腔内吸入的空气与肺毛细血管中的 血液进行换气(经肺通气进入人肺泡的新鲜空气与血液进行气体交换,氧气从肺泡顺着分压差扩散到静脉血,而静脉血中的二氧化碳,则向肺泡扩散的场所。[1,2]
从鼻腔通道到肺泡囊的整个人体呯吸道覆盖着一层连续的上皮细胞,但是传导区和呯吸区的上皮细胞在形态和细胞成分上却各有不同。在包括鼻腔通道、气管和支气管在内的传导区的最近端部位,呼吸道上皮细胞的形态为假复层纤毛柱状上皮细胞。距离传导区越远(分支增多,呼吸道内径缩小),此上皮细胞的厚度越薄,且在小呼吸道(细支气管)形成类似立方上皮细胞。大呼吸道上皮细胞主要由三种细胞类型构成:可分泌粘液的 杯状细胞、可通过与顶部纤毛进行协同摆动而促进粘液运动的纤毛细胞,以及在基底膜上排列目不与上皮细胞顶面接触的基底细胞。细支气管内 的立方上皮细胞由两种细胞类型构成:分泌细胞和纤毛细胞,但是其含有 的纤毛细胞数量要比近端大呯吸道所含数量要少。肺泡上皮细胞分为!型 肺泡上皮细胞和川型肺泡上皮细胞(AEC)。肺泡细胞通过毛细血管的内 皮细胞基膜,与内皮细胞融合,形成换气屏障。整个呼吸道内的细胞均为 各种低活跃度的细胞,包括大呼吸道内的神经内分泌细胞、分布在肺间质 内的肺泡巨噬细胞(吞噬细胞)(其主要作用是清除气腔内存在的和吸入 的空气中的尘粒、细菌等异物)。[13]
上皮细胞屏障和防御功能
呼吸道上皮细胞在协调空气进出肺泡的过程中,发挥着重要作用。呼吸道 上皮细胞可以阻挡和清除随空气进入呼吸道的颗粒、异物,使进入肺泡 的气体几乎清洁无菌,这一防御作用至关重要。其主要的防御手段是综合 利用分泌细胞和纤毛细胞的功能,因为分泌细胞会分泌出粘液,覆盖在纤 毛细胞的纤毛上,纤毛协调摆动,将粘液层与附着在粘液层上的随空气吸 入呼吸道的异物向咽喉方向移动,直至到达咽部,被吞咽或咳出。4,5其他,各种宿主防御机制也保证了呼吸道上皮细胞可以正常有效的发挥保护作 用。重要的是,上皮细胞层并非是独立发挥防御作用,而是与其他上皮细 胞、间充质细胞、内皮细胞和细胞外基质一起,作为共生的功能单元,协调 发挥作用。6.7.8
另外上皮细胞可以通过细胞间连接形成另一层防御屏障,有效的阻止病原 体或有毒物质进入体内。通过细胞间紧密连接,控制阻渗层,限制顶层腔 室和基底外侧腔室间分子的被动流动。细胞间紧密连接也是维持离子和 溶质体内平衡的重要因素,从而实现对呼吸道表面液体厚度和离子组成 控制,这是保护肺部的必要手段。。
尽管人上呼吸道存在这些有效的防御系统,但是呼吸道上皮细胞长期接 触外部空气,必然导致经常受损。呼吸道上皮细胞受损后,导致基底膜部 分或全部外露,仅有基底细胞群与基底膜相连。这些结构与功能的典型变,异是由肺部每天饱受各种自然颗粒物、人为颗粒物、纤维物质和化学品 等各种随空气吸入的物质的伤害而形成,由此导致患上慢性支气管炎、哮喘、慢性阳塞性肺病(COPD)或囊胞性纤维症(CF)等各种呼吸疾病。一旦受损,呼吸道上皮细胞会自动进行修复,以期恢复细胞屏障的完整性 和正常的上皮细胞功能,但是这些修复机制尚未完全为人所知。[1,5,10,11]
呼吸道特定区域的干细胞与祖细胞
呼吸道上皮细胞一直进行着缓慢而持续的动态代谢平衡。当发生中轻度 损伤,呼吸道上皮细胞会及时做出反应,重建上皮细胞层,恢复其正常的 结构和功能。这个上皮细胞修复的过程主要由呼吸道干细胞和祖细胞来 完成。11-18
上皮祖细胞生物学领域内,描述不同祖细胞的术语有些复杂而没有统一 标准化。在本篇综述中,我们用”祖细胞”一词来概括地定义相对而言未分 化的,具有增殖和分化潜能的细胞,而干细胞属于祖细胞里的一种罕有细 胞,具有持续增殖、自我更新和多向分化潜能。相比之下,很多成年祖细胞,是短暂扩充细胞,可以广泛增殖成为终未分化细胞,但是与干细胞相比,其寿命周期有限。12,13,19
有证据表明:不同种类的上皮于细胞和祖细胞分布在肺部的,位置不同:基 底细胞分布在气管和大支气管,2细支气管肺泡于细胞(BASC)分布在细 支气管肺泡管连接处(BADJ),21型肺泡上皮细胞则分布在肺泡区。22
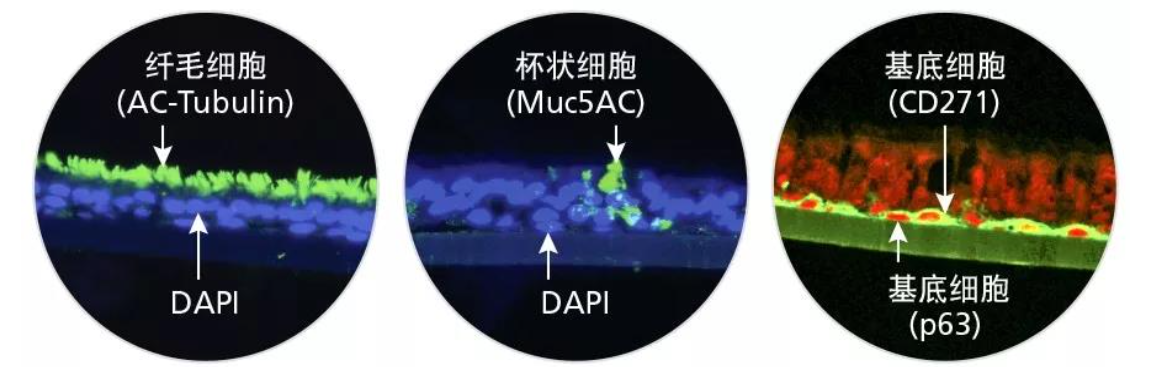
基底细胞
越来越多的证据表明:基底细胞为分布在气管支气管部位的多能祖细胞,在出生后不同发育阶段和稳态周期内,既可讲行自我更新,又可形成纤毛 细胞谱系和分泌细胞谱系,并且可以在上皮细胞受损后,进行修复。以上认知是从体内遗传谱系示踪研究和体外培养(气波界面(ALI)培养和三 维球状形态(克隆形态)培养中总结出来20,23,24 这些方法均需用标志物对基底 细胞进行精准标示,但是这些标志物对基底细胞祖细胞的功能的。在运用此类培养技术,可以 发挥单细胞自我更新和分化的潜能。上的重要 性尚不明确,应用最广泛的基底细胞标志物有P63、IGTA6、NGFR、KRT5 和KRT14。19,20.23:27所有这些标志物中,最为常用的是KRT5和KRT14。KRT5 可以在所有的基底细胞中进行标记,而只有当上皮细胞的代谢速率较低 时,通常采用 KRT14来标记出稳态子代基底细胞。2 这就说明:不同基底 细胞间存在功能异质性,只有少数基底细胞能够形成多个成熟细胞谱系。根据KRT14-CreER追踪,对小鼠气管和支气管上皮细胞进行的谱系示踪 研究的结果表明:在呼吸道受损的情况下,基底细胞子代可转化为多能或 单能细胞。
在对因强酸、洗涤剂或系统性萘摄入等各种介质摄入而使腔细胞受损,进 而进行修复的过程中,用KRT5和KRT14进行标记的双阳性基底细胞,无论,是单独存在或是以小集群形式存在的,均呈现出暂时性的数量增加。这一 结果表明:当基底细胞被激活“进行增殖时,KRT14标志物的表达水平上 调,23.28 但是,还有研究结果认为所有的基底细胞均能进行多向分化,而且 基底细胞祖细胞的分化命运是受到局部环境和损伤机制的影响。20
与人体肺部的再生疗法实际相关的一个问题是:基底细胞是否是唯一能 有效修复假复层上皮细胞的细胞,或分化的细胞是否能在特定条件下返 回祖细胞/或转分化成其它分化细胞,在Raia00pa实验室近期发表的一 篇主要论文中,采用了一种方法专门杀死小鼠体内气管中的KRT5+标志物 和基底细胞,29 在这种情况下,研究人员发现分化的 SCGB1A1+分泌细胞 可返回到祖细胞状态,转而成为P63和 KRT5标记的双阳性基底细胞。这 些基底细胞能够长期积蓄,与正常的KRT5+标记的祖细胞功能相似。通过 体外培养,论文作者进一步证明:基底细胞之间的细胞间连接可以阻止表 层分化细胞的去分化,但是还需对去分化的重新驱动程序的精准机制以 及随后产生的干细胞功能进行进一步研究。[29]
分泌细胞(Club cell)
与人体肺部的再生疗法实际相关的一个问题是:基底细胞是否是唯一能有效修复假复层上皮细胞的细胞,或分化的细胞是否能在特定条件下去分化或转分化。在Rajagopal实验室近期发表的篇主要论文中,采用了一种方法专门杀死小鼠体内气管中的KRT5标志物和基底细胞,在这种情况下,研究人员发现分化的 SCGB1A1+分泌细胞可返回到祖细胞状态,转而成为P63和 KRT5标记的双阳性基底细胞。这些基底细胞能够长期积蓄,与正常的KRT5标记的祖细胞功能相似,通过体外培养,论文作者进一步证明:基底细胞之间的细胞间连接可以阻止表层分化细胞的去分化。但是还需对去分化的重新驱动程序的精准机制以及随后产生的干细胞功能进行进一步研究。
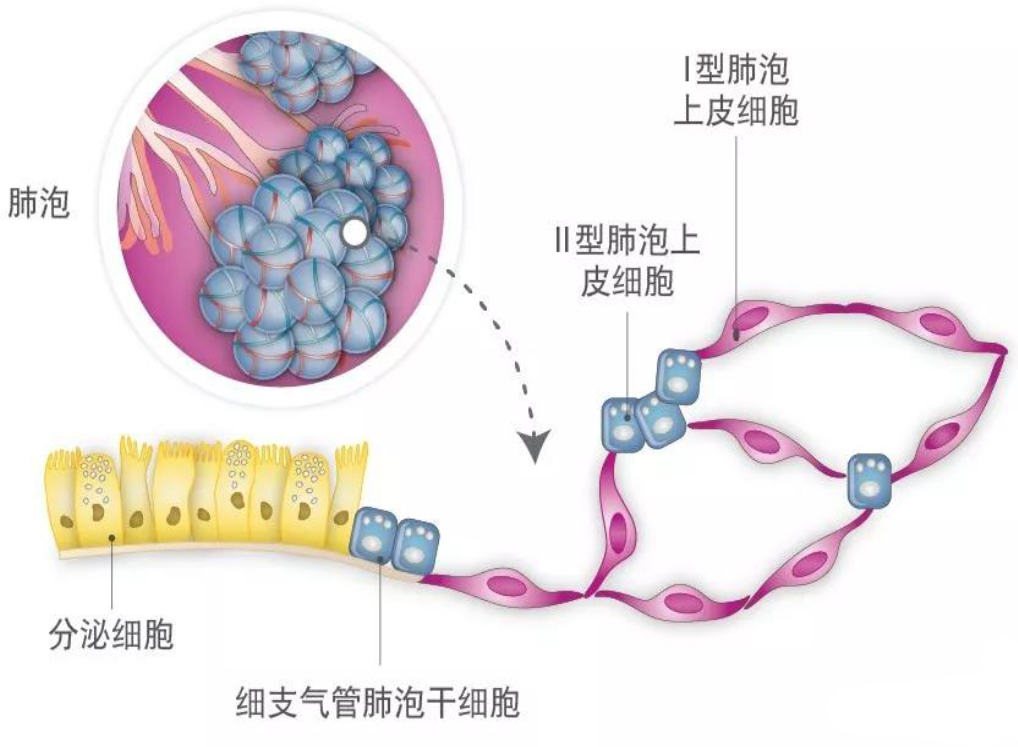
细支气管肺泡干细胞(BASC)
最细小的未端细支气管与肺泡之间的过渡区被称之为细支气管肺泡管连 接处。小鼠体内的此部位包含纤毛细胞和分泌细胞,但是人体内的此部位 所分布的细胞,尚不明确。将小鼠体内细支气管肺泡管连接处的少量细 胞(每个气管有1-2个胞)共同标记为Scob1a1(分泌细胞)和肺泡表面活 性蛋白C(Shpc),肺泡表面活性蛋白C是I型肺泡上皮细胞特有的一种蛋 白。其结论为:此类双阳性细胞为细支气管肺泡千细胞。之所以被称之为 细支气管肺泡干细胞,是因为当被荧光活化细胞分选方法所分离时,此类细胞会在培养皿中生成细支气管细胞和肺泡细胞。[30]Kim及其同事 进一步通过采用精致的3D克隆共同培养方法,证明了肺内皮细胞中的 BMP4-NFATC1-TSP轴可以诱导细支气管肺泡干细胞分化成肺泡谱系。[21]
II型肺泡上皮细胞(AEC2)
气体交换部位的主要上皮细胞类型包括:立方II型肺泡上皮细胞(主要生 产和分泌表面活性蛋白)和扁平的!型肺泡上皮细胞(主要进行换气)。成 年小鼠的肺泡部位的细胞新陈代谢一般比较慢,因此很难追踪到稳态的 谱系关系。但是,在对肺泡细胞进行实验性损伤,或让其接受氧化应激作 用的情况下,存活的细胞将快速增殖,并激活细胞修复机制。
过去40年一直采用H3胸昔标记法进行的研究结果表明,当因组织内氧气,过多或一氧化碳过多导致上皮细胞受损后,成年猴和小鼠的”型肺泡上皮 细胞会进行增殖,并形成型肺泡上皮细胞。近期,针对体内遗传谱系示踪 的研究肯定了成熟的川型肺泡,上皮细胞有这种自我更新和分化能力。上述 体内遗传谱系示踪研究采用与终未分化细胞(包括肺泡表面活性蛋白C和Lyz2)相关的基因驱动的Cre重组酶,在稳态的新陈代谢情况下,单个!型 肺泡,上皮细胞很少发生克峰性增殖,亦很少分化为(型肺泡上皮细胞。当博菜霉素和氧气过多对肺泡部位造成损伤之后,标记为”型肺泡上皮细胞,的谱系分化为|型肺泡上皮细胞的比例明显增高。[22,31-34]
近年来,干细胞和祖细胞谱系的识别以及这些细胞在成人体内的活动的,相关研究发展很快。相对而言,分子水平的信号通道对细胞行为的调控方 面的研究发展缓慢普遍认为,个体发育过程中使用的主要分子信号通 路在肺部细胞修复过程中被激活而发挥着重要作用,但是这些观点需要 进一步在生理或临床相关实验模型上测试证明。探索肺形成的机制,尤 其是肺泡形成领域的研究,方兴未艾。支气管上皮的气液界面培养系统, 和近几年流行起来的体外类器官培养(支气管类器官和肺泡类器官)系统 为解决这些呼吸领域的问题提供了最佳的技术支撑和研究平台。
Reference
1.Berube K, et al. Altern Lab Anim 37:89-141.2009
2.Crystal RG, et al Proc Am Thorac Soc 5:772-777,200
3.Kaisani A,et al. Differentiation 87:119-126.2014
4.Randell SH.Proc Am Thorac Soc 3: 718-725.2006
5.LivraghiA and Randell SH. Toxicol Pathol 35:116-129.2007
6.Rock JR.et al Proc Natl Acad SciU SA 108: E1475-1483.2011
7Weaver M,et al. Dev Biol 258:169-184.2003
8.Knight DA, et al. Expert Rev Respir Med. 4(6):747-58.2010
9.Matsui H,et al J Clin Invest 102:1125-1131.1998
10.Rawlins EL, et al. Proc Natl Acad Sci U SA 104: 410-417.2007
11.BorokZ,et al.Proc Am Thorac Soc 8:215-222.2011
12.Hogan BL,et al. Cell Stem Cell 15:123-138.2014
13.Kotton DN and Morrisey EE.Nat Med 20:822-832.2014
14.Rock JR and Hogan BL. Annu Rev Cel Dev Biol 27: 493-512.2011
15.Rock JR,et al. Dis Model Mech 3:545-556.2010
16.Stripp BR and Reynolds SD. Proc Am Thorac Soc 5: 328-333, 2008
17.Wansleeben C,et al. Dev Biol 2:131-148.2013
18.HackettTL,et al.Stem Cells 26(10)2576-85.2008
19.Reynolds SD, et al. Proc Am Thorac Soc 9: 27-37.2012
20.Rock JR, et al Proc Natl Acad SciU S A 106: 12771-12775.2009
21.Lee JH, et al. Cell 156:440-455.2014
22 Barkauskas CE et al J Clin Invest 123:3025-3036.2013
23.Cole BB,et al. Am J Pathol 177:362-376.2010
24.Ghosh M, et al Am J Respir Cell Mol Biol 45:459-469.2011
25 .Ghosh M,et al Stem Cells 31:2767-2778,2013
26.Ahmad S, et al. Am J Respir Cell Mol Biol 48:94-104,2013
27.Ghosh M,et al Am J Respir Cell Mol Biol 45:403-410,2011
28.Ghosh M, et al Am J Respir Cell Mol Biol 49:1127-1134.2013
29 Tata PR et al Nature 503:218-223.2013
30.Giangreco A,et al.AmJPathol 161:173-182.2002
31.Desai TJ,et al. Nature 507:190-194.2014
32 Evans MJ,et al Exp Mol Mathol 22 142-150.1975
33.Evans MJ,et al Am J Pathol 70:175-198.1973
34.Kaplan HP et al.Lab Invest 20:94-100.1969
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/14/气道上皮细胞及其干细胞和祖细胞/
- 版权声明: 转载请注明出处,谢谢。

