Lauren E-A Eyssen ,SR Siva Ramadurai,SA Sahar Abdelkarim,IB Imogen Buckle,KC Katy Cornish,HL Hong Lin,AJ A.K. Jones,GS Gary J. Stephens,RO Raymond J. Owens
In Press, 第一次发布时间: 2024年02月29日 原文DOI: 10.21769/BioProtoc.4962
评审: Luis Alberto Sánchez VargasJaveena HussainDogan Can KirmanThirupugal Govindarajan
My Notes:
本文介绍了一种从羊驼免疫、库构建、筛选和小型表达以优先考虑结合克隆的标准工作流程,以及如何使用从表1中提出的三个载体对纳米抗体进行功能化,应用于成像和纯化等不同应用。通过阅读全文,我们可以得到以下几点启示:
- 纳米抗体的生成与应用:纳米抗体(VHHs)是一种源自骆驼科免疫球蛋白重链-仅亚群的重组抗原特异性单域抗体。它们的小分子尺寸、易于表达、高亲和力和稳定性使其成为生物医学科学中独特的靶向试剂,具有多种应用,如细胞和结构生物学研究、作为结晶学伴侣以及超分辨率显微镜的探针等。
- 工作流程的标准化:作者提出了一个标准化的纳米抗体发现工作流程,包括羊驼免疫、库构建、筛选和小型表达,以优先考虑结合克隆。这为其他研究人员提供了一个详细的指南,以简化纳米抗体的生成过程。
- 载体套件的应用:作者还介绍了哺乳动物和细菌载体套件,这些载体可以用于功能化选定的纳米抗体,应用于成像和纯化等不同应用。这为纳米抗体的进一步应用提供了灵活性和便利性。
- 研究工作的深度与广度:本文不仅提供了详细的实验步骤,还涵盖了多个方面,包括羊驼免疫、库构建、筛选、小型表达、载体应用等,展示了纳米抗体研究的深度和广度。
简化的具体流程包含以下几个步骤:
- 羊驼免疫:通过肌肉注射多达八种不同的蛋白质来在羊驼中产生抗体。
- 库构建:从免疫后的羊驼血液中分离多形核白细胞(PMNCs),提取RNA并反转录为cDNA。
- 库筛选:通过噬菌体显示技术筛选VHH库,并进行多轮筛选以富集目标抗原的结合克隆。
- 小型表达:对筛选出的克隆进行小型表达和纯化,通过ELISA或BLI确认其与抗原的结合能力和解离速率。
- 载体应用:使用哺乳动物和细菌载体对选定的纳米抗体进行功能化,应用于成像和纯化等不同应用。
Abstract
Nanobodies是仅含重链的骆驼免疫球蛋白衍生出的重组抗原特异性单域抗体(VHHs)。它们的小分子大小、易于表达、高亲和力和稳定性使它们成为具有广泛生物医学应用的独特靶向试剂。从我们产生针对60多种不同蛋白的纳米抗体的工作中,我们提出了一个从骆驼免疫、文库构建、淘选和小规模表达以优先选择绑定克隆的纳米抗体发现的标准化工作流程。此外,我们还介绍了一系列哺乳动物和细菌载体,可用于针对如成像和纯化等各种应用的选定纳米抗体的功能化。
Key features
• 标准化构建纳米抗体文库和筛选纳米抗体结合体的流程,使其可以在任何具备合理设备的实验室中重复进行。
• 引入两组载体,使纳米抗体能在细菌或哺乳动物细胞中生产时实现功能化。
Graphical overview
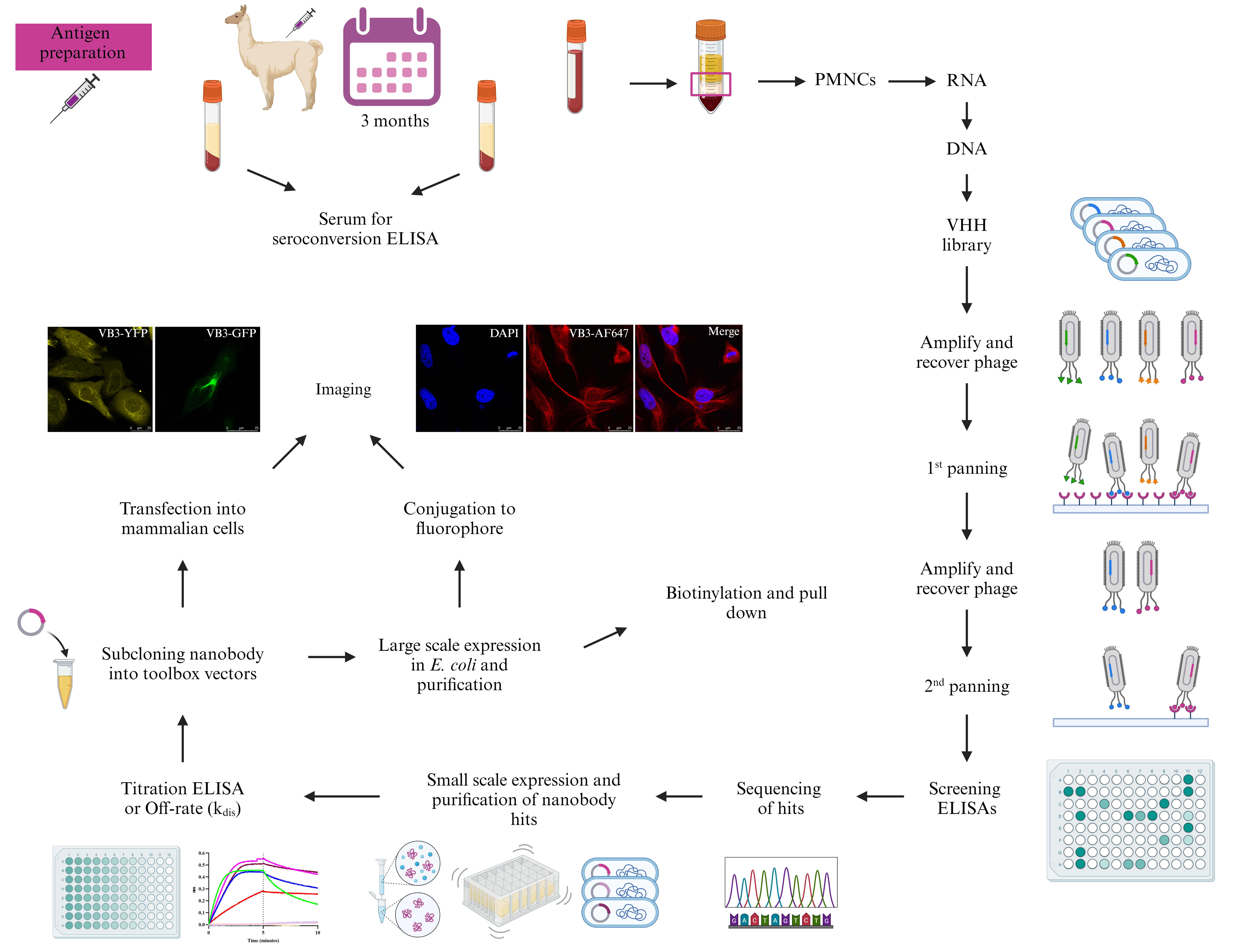
Keywords:[Camelid heavy chain–only antibody ](https://bio-protocol.org/cn/searchlist?content=Camelid heavy chain–only antibody)Nanobody
[Phage display
](https://bio-protocol.org/cn/searchlist?content=Phage display)[Nanobody labelling
](https://bio-protocol.org/cn/searchlist?content=Nanobody labelling)
Background
大约30年前,研究人员在比利时布鲁塞尔自由大学意外地发现了骆驼科动物产生独特的重链抗体[1]。比利时研究小组的开创性工作表明,这些抗体的可变重链域(VHH)可以产生为单一结合蛋白,即Nanobody。随后,人们已经生成了一系列针对各种抗原的Nanobodies,用于细胞和结构生物学应用,包括作为高价值膜蛋白和未折叠蛋白的结晶辅助蛋白和超分辨率显微镜探针[2]。典型的Nanobodies是通过对免疫骆驼和美洲驼外周血细胞中的VHH域克隆的噬菌体展示文库进行筛选,并与目标免疫原[3]共培养而生成的。自2019年以来,我们的团队已经产生了针对75种不同抗原的Nanobodies。这些抗原包括复合物、膜和可溶性蛋白质。我们确定的一些Nanobodies已经被应用于结构辅助蛋白[4]、诊断[5]和SARS-CoV-2[6]的抗病毒治疗以及体外和体内细胞生物学研究[7]。
虽然之前已经发表了几个生产Nanobodies的方案[8],但我们确定了可以简化流程的领域,例如引入无连接克隆来促进VHH域文库的构建,以及通过小规模表达筛选来确定高产克隆。
此外,通过使用通用的VHH克隆引物,我们已经设计了一套表达载体,可以将任何克隆的VHH功能化,与各种羧基末端标签如Flag、Avi-tag®或SNAP-tag®结合,以进行后续的特定位点标记。总的来说,我们的目标是将这项技术推广到任何配备合适设备的研究小组。
Materials and reagents
Biological materials
- 免疫后的肝素化骆马血
- 免疫前后骆马血清
- 电转化感受态TG1细胞(安捷伦,目录号码:200123)
- CM13K胰蛋白酶敏感的帮助噬菌体(抗体设计实验室,目录号码:PH050L)
- StellarTM感受态细胞(宝生物,目录号码:636766)
- 大肠杆菌(Migula)Castellani和Chalmers,WK6菌株(美国模式培养物集存库,目录号码:47078)
- BL21(DE3)-R3-pRARE2-BirA E. coli细胞,用于体内生物素化,SGC(结构基因组学联盟)
- HeLa细胞(美国模式培养物集存库,目录号码:CCL-2)
Reagents
Gerbu佐剂F(Biotechnik GmbH,目录号:3030)。储存在4°C。
NeutrAvidinTM生物素结合蛋白(Invitrogen,目录号:A2666)。储存在-20°C。
10× PBS(Fisher BioReagents,目录号:BP399-20),一般用途。储存在室温(RT)。
脱脂奶粉(Oxoid,目录号:LP0031)。储存在RT。
Tween-20(Sigma-Aldrich,目录号:P1379)。储存在RT。
BSA(Sigma-Aldrich,目录号:A2153)。储存在4°C。
山羊抗骆马IgG(H+L)HRP(Invitrogen,目录号:A16060)。分装为5μL并在-20°C储存。
KPL ABTS过氧化物酶溶液A(SeraCare,目录号:5120-0034)。储存在4°C。
KPL过氧化物酶底物溶液B(SeraCare,目录号:5120-0037)。储存在4°C。
ChemgeneTM(Chemgene&Trade,目录号:XTM308)。储存在RT。
警告:该化学品具有腐蚀性。
乙醇(EtOH)(Fisher BioReagents,目录号:E/0650DF/17)。储存在RT的易燃液体储存柜内。
警告:该化学品具有易燃性。
Virkon®(Rely+onTM,目录号:12358667)。储存在RT。
警告:该化学品具有腐蚀性。
PBS,pH 7.4,用于多形核粒细胞(PMNC)分离(Gibco,目录号:10010015)。储存在4°C。
Histopaque®-1077(Sigma-Aldrich,目录号:10771)。储存在4°C。
RNaseZapTM RNase除污溶液(Invitrogen,目录号:AM9782)。储存在RT。
奴卡醌溶液,0.4%(Sigma-Aldrich,目录号:T8154-20ML)。储存在RT。
警告:该化学品可能带有致癌性。
TRIzolTM试剂(Invitrogen,目录号:15596026)。储存在4°C。
警告:该化学品具有腐蚀性和毒性。
氯仿(Fluorchem,目录号:D007F)。储存在RT的易燃液体储存柜内。
警告:该化学品具有易燃性。
2-丙醇(Sigma-Aldrich,目录号:I9516)。储存在RT的易燃液体储存柜内。
无核酶自由水(非DEPC处理)(Invitrogen,目录号:AM9932)。储存在室温(RT)
SuperScriptTM IV一步逆转录PCR系统(Invitrogen,目录号:12594025)。储存在-20°C
CALL_001引物 5′-GTCCTGGCTGCTCTTCTACAAGG-3′。从IDT订制引物。储存在RT,重悬于水后储存在-20°C
CALL_002引物 5′-GGTACGTGCTGTTGAACTGTTCC-3′。从IDT订制引物。储存在RT,重悬于水后储存在-20°C
6× DNA凝胶加样缓冲液(New England Biolabs,目录号:B7024S)。储存在4°C
10× TBE缓冲液(Thermo Scientific,目录号:B52)。储存在RT
琼脂糖(Fisher BioReagents,目录号:BP1356-500)。储存在RT
1,000× SYBR TM安全DNA凝胶染色(Invitrogen,目录号:S33102)。储存在RT
GeneRuler 1 kb DNA梯子(Thermo Scientific,目录号:SM0311)。储存在4°C
Nucleospin凝胶和PCR清洁试剂盒(Macherey-Nagel,目录号:740609.50)。储存在RT
Purelink PCR纯化试剂盒(Invitrogen,目录号:K310002)。储存在RT
HyperLadderTM 1 kb DNA梯子(Meridian Bioscience®, Bioline,目录号:BIO-33053)。储存在4°C
Phusion flash 高保真PCR主混合液(Invitrogen,目录号:F548L)。储存于-20°C。
VHHFor2引物 5′-TACTCGCGGCCCAGCCGGCCATGGCCCAGGTGCAGCTGCAGGAGTCT GGRGGA-3′。由IDT订制引物。重悬于水前储存在RT,之后储存于-20°C。
VHHRev引物 5′-GTGATGGTGTTGGCCTCCTGAGGAGACGGTGACCTGG-3′。由IDT订制引物。重悬于水前储存在RT,之后储存于-20°C。
pADL23c载体(抗体设计实验室,目录号:PD0111)。储存于-20°C。
SfiI(新英格兰生物实验,目录号:R0123S)。储存于-20°C。
10× rCutSmartTM缓冲液(新英格兰生物实验,目录号:B6004S)。储存于4°C。
ClonExpress II一步克隆试剂盒,含5×CEII缓冲液和Exnase II(Vazymbiotech,目录号:C112-02)。储存于-20°C。
恢复培养基(Sigma-Aldrich,目录号:S1797)。储存于4°C。
LB培养基混合物(Formedium,目录号:LBL0103)。储存于RT。
Bacto蛋白胨(Melford,目录号:T60065-2000.0)。储存于室温(RT)。
酵母提取物(Melford,目录号:Y20020-1000.0)。储存于室温(RT)。
Bacto琼脂(Formedium,目录号:AGR10)。储存于室温(RT)。
阿霉素(Formedium,目录号:AMP100)。储存于4°C。
警告:阿霉素是一种致敏剂。
25 mM dNTP(Termo Scientific,目录号:R1122)。在30 µL分装中储存于-20 °C。
Taq聚合酶与标准Taq反应缓冲液(New England Biolabs,目录号:M0273X)。储存于-20 °C。
PhD_seq_Fwd引物 5′-GCTTCCGGCTCGTATGTTG-3′。储存于-20 °C。
PhD_seq_Rev引物 5′-GTCGTCTTTCCAGACGTTAG-3′。储存于-20 °C。
甘油(Sigma-Aldrich,目录号:G5516-1L)。储存于室温(RT)。
PEG 6000(Sigma-Aldrich,目录号:81260)。储存于室温(RT)。
NaCl(Sigma-Aldrich,目录号:S9888)。储存于室温(RT)。
卡那霉素(Sigma-Aldrich,目录号:K1377)。储存于4 °C。
警告:卡那霉素是一种致敏剂,可能损害生育力。
StartingBlockTM(PBS)封闭缓冲液(Invitrogen,目录号:37538)。储存于4 °C。
DynabeadsTM M-280亲和素(Invitrogen,目录号:11205D)。储存于4 °C。
三羟甲基氨基甲烷(Tris, Melford,目录号:T60040-100.0)。储存于室温(RT)。
氯化钙二水合物(Sigma-Aldrich, 目录号:C3306)。储存于室温(RT)
胰蛋白酶(Sigma-Aldrich, 目录号:T1426)。储存于-20 °C
反-M13 HRP(Sino Biological, 目录号:11973-MM05T-H)。分装为5 µL并在-20 °C储存
Highprep PCR磁性珠(Magbio, 目录号:AC60050)。储存于4 °C
葡萄糖(Sigma-Aldrich, 目录号:G8270)。储存于室温(RT)
氯化镁六水合物(Sigma-Aldrich, 目录号:M2670)。储存于室温(RT)
异丙基硫代半乳糖苷(IPTG)(NeoBiotech, 目录号:NB-45-00030)。储存于-20 °C
硫酸多粘菌素B(Gibco, 目录号:21850029)。储存于室温(RT)
警告:硫酸多粘菌素B有毒。
2× Laemmli缓冲液(Sigma-Aldrich, 目录号:S3401)。储存于4 °C
20× NuPAGETM MES SDS电泳缓冲液(Invitrogen, 目录号:NP000202)。储存于室温(RT)
Mark12TM未染色标准(Invitrogen, 目录号:LC5677)。储存于4 °C
InstantBlue® Coomassie蛋白染色剂(Abcam, 目录号:ab119211)。储存于4 °C
Ni-NTA旋转柱(QIAGEN, 目录号:31014)。储存于4 °C
醋酸咪唑(Sigma-Aldrich, 目录号:I202-500g)。储存于室温(RT)
警告:醋酸咪唑有毒、腐蚀性、刺激性,可能损害生育能力。
ZebaTM旋转除盐柱,7K MWCO,0.5 mL(Thermo Scientific, 目录号:89882)。储存于4 °C
兔抗骆驼科动物VHH HRP(GenScript, 目录号:A01861-200)。分装为5 µL并在-20 °C储存
pOPINVHH_his载体(Addgene, 目录号:210405)。储存于-20 °C
pOPINVHH_cys_his载体(Addgene,目录号:210403)。储存于-20°C。
pOPINVHH_BAP_his载体(Addgene,目录号:210402)。储存于-20°C。
pOPINVHH_sort_his载体(Addgene,目录号:210406)。储存于-20°C。
pOPINVHH_flag_his载体(Addgene,目录号:210404)。储存于-20°C。
pOPINVHH_myc_his载体(Addgene,目录号:210526)。储存于-20°C。
pOPINVHH_snap_his载体(Addgene,目录号:210407)。储存于-20°C。
pOPINE-3C-eGFP载体(Addgene,目录号:41125)。储存于-20°C。
pOPINE-3C-eYFP载体(Addgene,目录号:214028)。储存于-20°C。
pOPINE-3C-mCherry载体(Addgene,目录号:214060)。储存于-20°C。
共用正向引物 5′-GCGGCCCAGCCGGCCATGGCCCAGGTGCAGCTGGTGGAG-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
His FLAG反向引物 5′-GTGATGGTGGCCTGAGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
Cys反向引物 5′-ATGGTGACAGCCTGAGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
BAP反向引物 5′-ATCATTCAAGCCTGAGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
sort反向引物 5′-CGGCAGGCCGCCTGAGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
Myc反向引物 5′-GTGATGGTGGTGGCCTGAGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
SNAP反向引物 5′-GTCCTTGTCGCCTGAGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
pOPINE共用正向引物 5′-AGGAGATATACCATGCAGGTGCAGCTGGTGGAG-3′。从IDT订制引物。在重悬于水之前储存在RT,之后储存于-20°C。
pOPINE 共用反向引物 5′-CAGAACTTCCAGTTTAGGGGAGACGGTGACCTGGGTC-3′。从IDT订制引物。在重悬于水之前储存在室温(RT),之后储存于-20°C。
Bsu36I (New England Biolabs,目录号:R0524S)。储存于-20°C。
NcoI (New England Biolabs,目录号:R01093S)。储存于-20°C。
X-gal即用(Thermo Scientific,目录号:R0941)。储存于4°C。
QIAprep旋转小量质粒提取试剂盒(QIAGEN,目录号:27104)。储存于RT。
抗GFP纳米抗体DNA序列[9]经大肠杆菌表达密码子优化后。CAG GTC CAA TTA GTG GAG TCC GGT GGG GCA CTT GTC CAG CCT GGA GGT TCA CTT CGC TTG TCT TGC GCA GCG TCT GGA TTC CCG GTG AAC CGC TAT AGT ATG CGT TGG TAC CGT CAA GCT CCG GGG AAA GAA CGT GAA TGG GTA GCA GGG ATG TCT TCC GCC GGT GAC CGC TCT TCA TAC GAG GAC TCG GTC AAG GGG CGC TTC ACA ATC TCT CGT GAT GAT GCC CGT AAC ACC GTT TAC TTG CAA ATG AAC AGC CTG AAA CCG GAA GAC ACT GCG GTG TAT TAC TGC AAT GTT AAT GTA GGG TTT GAA TAC TGG GGT CAA GGT ACA CAA GTT ACA GTT TCG TCA。从IDT订制gBlock。在重悬于TE缓冲液之前储存在RT,然后在50°C下孵育20分钟,之后储存于-20°C。
氯霉素(Sigma-Aldrich,目录号:C1919)。储存于4°C。
警告:氯霉素有毒,可能造成眼损伤,并具有致癌性。
丁胺卡那霉素二盐酸盐五水合物(Sigma-Aldrich,目录号:S4014)。储存于4°C。
警告:丁胺卡那霉素具有刺激性。
卡比西林二钠盐(Sigma-Aldrich,目录号:C3416)。储存于4°C。
警告:卡比西林是一种致敏剂。
生物素(Sigma-Aldrich,目录号:B4639)。储存于4°C。
荧光标记亲和素(Alexa FluorTM 488结合)(Invitrogen,目录号:S11223)。分装为5 μL并在-20°C储存。
BenchMarkTM荧光蛋白标准品(Invitrogen,目录号:LC5928)。储存条件:-20°C。
抗波形蛋白(VB3)纳米体的DNA序列(经密码子优化,适用于在大肠杆菌中表达)[10]:CAG GTC CAA CTT GTA GAG TCA GGA GGT GGA AGC GTG CAA GCT GGG GAC TCT CTG CGC CTG TCT TGT GCT TCG AGC GGA AAT ACC TTC TCG ATC AAA GTC ATG GGA TGG TAC CGC CAG GCA CCT GGA AAG CAA CGT GAA TTA GTC GCG GTT TCA ACC AAT AGC GGG GCC TCT GTT AAT TAT GCC AAC TCT GTG AAG GGA CGC TTT ACC ATT TCT ATT GAT TCA GTA AAA AAA ACA ACC TAC TTA CAG ATG AAT TCC TTG AAG CCA GAA GAT ACA GCC GTC TAC TTT TGC AAT GCA TAT GAT GGG CGT TAT GAG GAC TAT TAC GGT CAG GGG ACC CAA GTG ACA GTA TCA TCA。从IDT订购gBlock。在TE缓冲液中重组成前,储存条件:室温;之后在50°C下孵育20分钟,储存条件:-20°C。
TCEP盐酸盐(Merck,Millipore®,目录号:580567-5GM)。储存条件:室温。
Alexa FluorTM 647 C2-马来酰亚胺(Invitrogen,目录号:A20347)。储存条件:-20°C。
ZebaTM染料和生物素去除柱(Thermo Scientific,目录号:A44296)。储存条件:4°C。
PageRulerTM预染蛋白分子量标准(Thermo Scientific,目录号:26616)。储存条件:4°C。
高糖DMEM,含HEPES,无酚红(Gibco,目录号:21063-029)。储存条件:4°C。
胎牛血清(FBS)(Biowest,目录号:S00NB1001Y)。储存条件:-20°C。
100× GlutaMAXTM(Gibco,目录号:35050-038)。储存条件:-20°C。
100×青霉素-链霉素(Gibco,目录号:15140-122)。储存条件:-20°C。
4%多聚甲醛PBS溶液(Thermo Scientific化学品,目录号:J61899.AK)。储存条件:4°C。注意事项:多聚甲醛是眼睛刺激剂,皮肤致敏剂和致癌物。
TritonTM X-100(Sigma-Aldrich,目录号:T8787-250mL)。储存条件:室温。
Fluoroshield含DAPI(Abcam,目录号:ab104139)。储存条件:室温。
指甲油。储存条件:室温。
F型浸入液(Leica,目录号:11513859)。储存条件:室温。
Fugene转染试剂(Promega,目录号:E2311)。储存条件:4°C。
Solutions
- 0.5 mg/mL中性亲和素生物素结合蛋白(见配方)
- 10 µg/mL中性亲和素用于ELISA板包被(见配方)
- 1× PBS(见配方)
- 封闭溶液(见配方)
- 洗涤缓冲液(PBST)(见配方)
- 0.1%(w/v)BSA-PBS(见配方)
- 5%(v/v)Chemgene(见配方)
- 70%(v/v)乙醇(EtOH)(见配方)
- 2%(w/v)Virkon(见配方)
- 75%(v/v)EtOH(见配方)
- 1× TBE缓冲液(见配方)
- 0.7%(w/v)含1× SYBRTM Safe DNA凝胶染料的琼脂糖凝胶(见配方)
- 1%(w/v)含1× SYBRTM Safe DNA凝胶染料的琼脂糖凝胶(见配方)
- 2× YT培养基(见配方)
- LB培养基(见配方)
- 100 mg/mL氨苄西林(见配方)
- 1%(w/v)含100 µg/mL氨苄西林的琼脂LB平板(见配方)
- 2%(w/v)含100 µg/mL氨苄西林的琼脂LB平板(见配方)
- 50%甘油(见配方)
- 含25%甘油的2× YT培养基(见配方)
- 1%(w/v)不含抗生素的琼脂LB平板(见配方)
- 含100 µg/mL氨苄西林的2× YT培养基(见配方)
- 50 mg/mL卡那霉素(见配方)
- 含25 µg/mL卡那霉素的2× YT培养基(见配方)
- PEG/NaCl沉淀溶液(见配方)
- 含100 µg/mL氨苄西林和25 µg/mL卡那霉素的2× YT培养基(见配方)
- TBSC(见配方)
- 1 mg/mL胰蛋白酶(见配方)
- 250 µg/mL胰蛋白酶(见配方)
- Terrific broth (见配方)
- 20%(w/v)葡萄糖(见配方)
- 1 M MgCl2·6H2O(见配方)
- 含100 µg/mL氨苄西林、0.1%葡萄糖、2 mM MgCl2·6H2O的Terrific肉汤(见配方)
- 1 M IPTG(见配方)
- 1 mg/mL硫酸多粘菌素B在PBS中(见配方)
- 1× NuPAGETM MES SDS运行缓冲液(见配方)
- 平衡缓冲液(见配方)
- 洗脱缓冲液(见配方)
- Octet稀释缓冲液(见配方)
- 1%(w/v)含100 µg/mL氨苄西林、2 mM IPTG、40 µg/mL X-gal的琼脂LB平板(见配方)
- 34 µg/mL氯霉素(见配方)
- 50 µg/mL壮观霉素(见配方)
- 50 µg/mL羧苄西林(见配方)
- 1%(w/v)含34 µg/mL氯霉素、50 µg/mL壮观霉素、50 µg/mL羧苄西林的琼脂LB平板(见配方)
- 0.2 M 生物素(见配方)
- 含50 µg/mL壮观霉素和50 µg/mL羧苄西林的Terrific肉汤(见配方)
- 1 mg/mL链霉亲和素Alexa FluorTM 488偶联物(见配方)
- 50 µg/mL链霉亲和素Alexa FluorTM 488偶联物(见配方)
- 500 mM TCEP, pH 8.0(见配方)
- 1 mM TCEP, pH 8.0(见配方)
- 10 mg/mL Alexa FluorTM 647 C2-马来酰亚胺(见配方)
- 不含酚红的DMEM培养基,含10%(v/v)FBS,1× GlutaMAXTM,1×青霉素-链霉素(见配方)
- 共聚焦阻断缓冲液(见配方)
- 共聚焦稀释缓冲液(见配方)
配方
0.5 mg/mL中性亲和素生物素结合蛋白
制备200 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume neutrAvidinTM 0.5 mg 5 mg ddH2O n/a 10 mL Total n/a 10 mL
注:在本文中,neutrAvidinTM 被提及作为一种可以在纳米抗体筛选过程中使用的配体。它与链霉亲和素(streptavidin)类似,可以与生物素(biotin)高亲和力结合。在纳米抗体的筛选过程中,neutrAvidinTM 通常被用于捕获带有生物素标签的抗原,以便后续通过洗脱步骤来鉴定与抗原结合的纳米抗体。
简而言之,neutrAvidinTM 是一种生物素亲和配体,用于纳米抗体筛选中的抗原捕获步骤,以鉴定与特定抗原结合的纳米抗体。
10 µg/mL中性亲和素用于ELISA板包被
使用前现配。
Reagent Final concentration Quantity or Volume neutrAvidinTM (Recipe 1) 10 µg/mL 200 µL PBS (1×) 1× 9.8 mL Total n/a 10 mL 1× PBS
准备无菌(通过高压蒸汽灭菌)和非无菌PBS。储存条件:室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume PBS (10×) 1× 100 mL ddH2O n/a 900 mL Total n/a 1,000 mL 封闭溶液
使用当天配制。
Reagent Final concentration Quantity or Volume Milk 2% (w/v) 2 g PBS (Recipe 3) (or buffer that is compatible with the protein) n/a 100 mL Total n/a 100 mL 洗涤缓冲液(PBST)
储存条件:室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume PBS (Recipe 3) 1× 1 000 mL Tween-20 0.05% (v/v) 500 µL Total n/a 1,000 mL 0.1%(w/v)BSA-PBS
使用当天配制。
Reagent Final concentration Quantity or Volume BSA 0.1 % (w/v) 50 mg PBS (Recipe 3) 1× 50 mL Total n/a 50 mL 5%(v/v)Chemgene
储存条件:室温。
Reagent Final concentration Quantity or Volume Chemgene (100%) 5% (v/v) 50 mL H2O n/a 950 mL Total n/a 1,000 mL 注:Chemgene是一种化学试剂,用于在实验室安全柜中进行消毒。文中提到在使用RNaseZapTM消毒工作表面、手套和任何进入安全柜的物品之前,会先用5%的Chemgene溶液喷洒安全柜。这表明Chemgene可能是一种含有消毒成分的溶液,用于减少实验室中的生物安全风险。
70%(v/v)乙醇(EtOH)
储存条件:室温。
Reagent Final concentration Quantity or Volume Ethanol (absolute) 70% (v/v) 70 mL H2O n/a 30 mL Total n/a 100 mL 2%(w/v)Virkon
每周配制,储存条件:室温。
Reagent Final concentration Quantity or Volume Virkon powder 2% (w/v) 100 g H2O n/a 5,000 mL Total n/a 5,000 mL 注:在本文中,Virkon powder(Virkon消毒粉)是一种用于实验室消毒的化学消毒剂。文中提到在使用RNaseZapTM消毒工作表面、手套和任何进入安全柜的物品之前,会先用5%的Virkon溶液喷洒安全柜。这表明Virkon powder可能是一种含有消毒成分的粉末,用于制备消毒溶液,以减少实验室中的生物安全风险。
75% (v/v) EtOH
Store at RT.
Reagent Final concentration Quantity or Volume Ethanol (absolute) 75% (v/v) 75 mL H2O n/a 25 mL Total n/a 100 mL 1× TBE buffer
Store at RT. Stable for at least one month.
Reagent Final concentration Quantity or Volume TBE (10×) 1× 100 mL H2O n/a 900 mL Total n/a 1,000 mL 注:TBE缓冲液是一种常用的缓冲剂,用于核酸电泳,特别是在聚丙烯酰胺凝胶电泳(PAGE)中。TBE代表Tris-Borate-EDTA,它由Tris(三羟甲基氨基甲烷)、硼酸(Borate)和EDTA(乙二胺四乙酸)组成。这种缓冲液的pH值约为8.8,能够为DNA片段的分离提供适宜的电泳条件。
在本文中,TBE缓冲液可能被用于DNA片段的PAGE分析,例如用于从噬菌体库中筛选出的纳米抗体基因片段的鉴定。通过在适当的电压和温度下电泳,DNA片段可以根据其大小在凝胶中分离,从而可以对它们进行分析和纯化。
0.7%(w/v)含1× SYBRTM Safe DNA凝胶染料的琼脂糖凝胶
在微波炉中加热至琼脂糖完全溶解,并在加入凝胶染料前冷却至55°C。倒入DNA浇注装置中,待其凝固。使用当天配制。
Reagent Final concentration Quantity or Volume Agarose 0.7 % (w/v) 0.7 g TBE (Recipe 11) 1× 100 mL Total n/a 100 mL SYBRTM Safe DNA gel stain (1,000×) 1× 10 µL 注:SYBRTM Safe DNA gel stain 是一种用于凝胶电泳的DNA染料,由Invitrogen公司生产。这种染料与DNA结合后,可以在凝胶电泳中染色DNA,使得DNA片段在凝胶中可视化,便于分析和观察。与传统的溴化乙锭(EB)染料相比,SYBRTM Safe DNA gel stain 具有较低的毒性和较少的细胞遗传学危害,因此在实验室中更安全。
在使用时,SYBRTM Safe DNA gel stain 通常在电泳完成后加入凝胶中,通过染色和脱色步骤来观察DNA片段。这种染料不会与RNA和蛋白质发生结合,因此可以特异性地染 DNA。此外,SYBRTM Safe DNA gel stain 不会在紫外线照射下发出荧光,因此不能用于荧光凝胶成像,但它提供了传统凝胶成像系统中DNA片段大小的可视化。
1%(w/v)含1× SYBRTM Safe DNA凝胶染料的琼脂糖凝胶
在微波炉中加热至琼脂糖完全溶解,并在加入凝胶染料前冷却至55°C。倒入DNA浇注装置中,待其凝固。使用当天配制。
Reagent Final concentration Quantity or Volume Agarose 1% (w/v) 1 g TBE (Recipe 11) 1× 100 mL Total n/a 100 mL SYBRTM Safe DNA gel stain (1,000×) 1× 10 µL 2× YT培养基
高压蒸汽灭菌后,储存于室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume Bacto tryptone 16 g/L 4 g NaCl 5 g/L 1.25 g Yeast extract 10 g/L 2.5 g ddH2O n/a 250 mL Total n/a 250 mL 注:YT培养基是一种常用的微生物培养基,代表酵母提取物- Tryptone 培养基。它含有酵母提取物和肉膏,为细菌提供了丰富的营养,通常用于实验室中培养大肠杆菌等细菌。
在本文中,YT培养基被用于培养TG1细胞,这是噬菌体展示实验中常用的宿主细胞。文中提到的YT培养基还含有氨苄青霉素,用于筛选含有抗氨苄青霉素抗性的重组噬菌体。
LB medium
通过高压蒸汽灭菌(autoclave)来确保无菌。
储存条件:室温。
稳定期至少一个月。Reagent Final concentration Quantity or Volume LB medium mix 25 g/L 6.25 g ddH2O n/a 250 mL Total n/a 250 mL 100 mg/mL 氨苄西林(Ampicillin)
使用0.22 µm滤器进行无菌过滤。制备500 µL分装,储存于-20°C。稳定期至少一年。
注意事项:氨苄西林是一种致敏剂。Reagent Final concentration Quantity or Volume Ampicillin 100 mg/mL 2 g ddH2O n/a 20 mL Total n/a 20 mL 1%(w/v)含100 µg/mL氨苄西林的琼脂LB平板
高压蒸汽灭菌LB培养基和琼脂混合物,并在加入抗生素前冷却至55°C。在安全柜中倒置混合并倒入8.5厘米的培养皿中。在室温下冷却。使用当天配制。
Reagent Final concentration Quantity or Volume LB medium mix 25 g/L 6.25 g Bacto agar 1% (w/v) 2.5 g ddH2O n/a 250 mL Total n/a 250 mL Ampicillin (Recipe 16) 100 µg/mL 250 µL 2%(w/v)含100 µg/mL氨苄西林的琼脂LB平板
高压蒸汽灭菌LB培养基和琼脂混合物,并在加入抗生素前冷却至55°C。在安全柜中倒置混合并倒入8.5厘米的培养皿中。在室温下冷却。使用当天配制。
Reagent Final concentration Quantity or Volume LB medium mix 25 g/L 6.25 g Bacto agar 2% (w/v) 5 g ddH2O n/a 250 mL Total n/a 250 mL Ampicillin (Recipe 16) 100 µg/mL 250 µL 50%(v/v)甘油
高压蒸汽灭菌后,储存于室温。稳定期至少一年。
Reagent Final concentration Quantity or Volume Glycerol 50% (v/v) 100 mL ddH2O n/a 100 mL Total n/a 200 mL 2× YT 培养基(含 25% (v/v) 甘油)
Prepare just before use in a safety cabinet.
Reagent Final concentration Quantity or Volume 2× YT medium n/a 20 mL Glycerol (Recipe 19) 25% (w/v) 20 mL Total n/a 40 mL 1%(w/v)不含抗生素的琼脂LB平板
高压蒸汽灭菌后,冷却至55°C。在安全柜中倒置混合并倒入8.5厘米的培养皿中。在室温下冷却并凝固。储存条件:4°C,可储存两周。
Reagent Final concentration Quantity or Volume LB medium mix 25 g/L 6.25 g Bacto agar 1% (w/v) 2.5 g ddH2O n/a 250 mL Total n/a 250 mL 含100 µg/mL氨苄西林的2× YT培养基
在安全柜中使用前现配。
Reagent Final concentration Quantity or Volume 2× YT n/a 100 mL Ampicillin (Recipe 16) 100 µg/mL 100 µL Total n/a 100 mL 50 mg/mL卡那霉素
使用0.22 µm滤器进行无菌过滤。制备100 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Kanamycin 50 mg/mL 0.5 g ddH2O n/a 10 mL Total n/a 10 mL 含25 µg/mL卡那霉素的2× YT培养基
在安全柜中使用前现配。
Reagent Final concentration Quantity or Volume 2× YT n/a 100 mL Kanamycin (Recipe 23) 25 µg/mL 50 µL Total n/a 100 mL PEG/NaCl沉淀溶液
高压蒸汽灭菌后,储存于室温。稳定期至少一年。
Reagent Final concentration Quantity or Volume PEG 6000 20% (w/v) 200 g NaCl 2.5 M 146.1 g ddH2O n/a Make up to 1,000 mL Total n/a 1,000 mL 注:本文中提到的PEG 6000是一种聚乙二醇,化学名称为polyethylene glycol 6000,分子式为HO(CH2CH2O)nH,其中n代表氧乙烯单元的个数。PEG 6000是一种非离子型表面活性剂,常用于生物化学和分子生物学实验中作为溶剂、稳定剂、冻干保护剂或用于制备蛋白质复合物。
在本文中,PEG 6000可能被用作电转染过程中的稳定剂,以帮助提高DNA转染效率。此外,PEG 6000也被用作制备纳米抗体库时的细胞裂解缓冲液的成分之一,可能有助于在细胞裂解过程中保持蛋白质的稳定性和完整性。
含100 µg/mL氨苄西林和25 µg/mL卡那霉素的2× YT培养基(双抗)
在安全柜中使用前现配。
Reagent Final concentration Quantity or Volume 2× YT n/a 100 mL Ampicillin (Recipe 16) 100 µg/mL 100 µL Kanamycin (Recipe 23) 25 µg/mL 50 µL Total n/a 100 mL TBSC
高压蒸汽灭菌后,储存于室温。稳定期至少一年。
Reagent Final concentration Quantity or Volume Tris base 10 mM 0.788 g NaCl 137 mM 4 g CaCl2·2H2O 1 mM 73.5 mg ddH2O n/a 500 mL Total n/a 500 mL 注:TBSC代表Tris-Buffered Saline with Ca2+ and Mg2+,即含有Ca2+和Mg2+的Tris缓冲盐水。这是一种常用的缓冲液,用于洗涤和稀释样品,尤其是在分子生物学实验中,如凝胶电泳和ELISA分析。TBSC缓冲液中的Ca2+和Mg2+离子对于某些实验步骤是必要的,例如在某些ELISA实验中,Mg2+离子是酶联免疫吸附实验中酶的激活剂。此外,TBSC缓冲液中的钙离子对于某些蛋白质的溶解和稳定性也是必需的。
1 mg/mL 胰蛋白酶
制备130 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Trypsin 1 mg/mL 50 mg ddH2O n/a 50 mL Total n/a 50 mL 250 µg/mL 胰蛋白酶
使用前现配。
Reagent Final concentration Quantity or Volume Trypsin (Recipe 28) 250 µg/mL 125 µL TBSC (Recipe 27) n/a 375 µL Total n/a 500 µL Terrific broth
高压蒸汽灭菌后,储存于室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume Bacto胰蛋白胨 12 g/L 3 g Yeast extract 24 g/L 6 g 甘油 0.4% (v/v) 1 mL KH2PO4 0.17 M 0.5775 g K2HPO4 0.72 M 3.135 g ddH2O n/a 250 mL Total n/a 250 mL 注:Terrific broth是一种常用的细菌培养基,通常用于培养大肠杆菌等细菌。它是一种复杂的营养培养基,含有多种氨基酸、维生素和矿物质,能够为细菌提供丰富的营养。
在本文中,Terrific broth用于培养经过筛选的纳米抗体克隆,以验证其在大肠杆菌中的表达。它通常与氨苄青霉素一起使用,以选择含有抗氨苄青霉素抗性的重组噬菌体。
20% (w/v) glucose
Filter sterilise using a 0.22 µm filter. Prepare 500 µL aliquots and store at -20 °C. Stable for at least one year.
Reagent Final concentration Quantity or Volume Glucose 20% (w/v) 20 g ddH2O n/a Make up to 100 mL Total n/a 100 mL 1 M MgCl2·6H2O
Filter sterilise using a 0.22 µm filter. Prepare 500 µL aliquots and store at -20 °C. Stable for at least one year.
Reagent Final concentration Quantity or Volume MgCl2·6H2O 1 M 4.066 g ddH2O n/a 20 mL Total n/a 20 mL 含100 µg/mL氨苄西林、0.1%葡萄糖、2 mM MgCl2·6H2O的Terrific broth
在安全柜中使用前现配。
Reagent Final concentration Quantity or Volume Terrific broth (Recipe 30) n/a 99.2 mL Ampicillin (Recipe 16) 100 µg/mL 100 µL Glucose (Recipe 31) 0.1% (v/v) 500 µL MgCl2·6H2O (Recipe 32) 2 mM 200 µL Total n/a 100 mL 1 M IPTG
使用0.22 µm滤器进行无菌过滤。制备500 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume IPTG 1 M 4.766 g ddH2O n/a 20 mL Total n/a 20 mL 注:IPTG 是异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-1-thiogalactopyranoside)的缩写,是一种常用的化学诱导剂,用于启动某些类型的细菌(如大肠杆菌)中的蛋白质表达。IPTG 可以与大肠杆菌中的 lac 操纵子上的 lac 操纵蛋白结合,从而激活 lac 操纵子控制的基因转录,包括 lac 操纵子控制的一些外源基因的表达。例如,在本文中,作者使用IPTG来诱导含有 lac 操纵子的噬菌体载体在大肠杆菌TG1中的蛋白质表达,以验证噬菌体库中筛选出的纳米抗体克隆的表达情况。通过IPTG的诱导,可以观察到目的蛋白的表达,从而选择适合进一步研究和应用的纳米抗体克隆。
1 mg/mL硫酸多粘菌素B在PBS中
制备1 mL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Polymyxin-B sulfate 1 mg/mL 2 mg PBS (Recipe 3) 1× 2 mL Total n/a 2 mL 注:Polymyxin-B sulfate是一种广谱的抗生素,属于多粘菌素(polymyxins)家族。它是由多粘杆菌产生的一组多肽类抗生素,具有杀菌作用,特别是对革兰氏阴性菌如大肠杆菌、克雷伯氏菌、变形杆菌和假单胞菌等有很强的抑制作用。
Polymyxin-B sulfate通常用于治疗革兰氏阴性菌引起的感染,如肠道感染、败血症、肺炎等。它也可以用于眼部或耳部的感染。然而,由于其具有严重的肾毒性和神经毒性,因此在使用时需要谨慎,并且通常仅在其他抗生素无效或无法使用的情况下考虑使用。
Polymyxin-B sulfate的主要作用机制是破坏细菌细胞膜的完整性,导致细胞内容物外泄,从而杀死细菌。由于其对细胞膜的破坏作用,它也可能对宿主细胞产生毒性,因此需要严格控制剂量和使用时间。
1× NuPAGETM MES SDS运行缓冲液
储存条件:室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume MES (20×) 1× 100 mL H2O n/a 1,900 mL Total n/a 2,000 mL 注:MES(2-(N-吗啡啉)乙磺酸)是一种有机化合物,分子式为C6H14NO4S,是一种常用于生物化学和分子生物学实验的缓冲剂。MES主要用于维持pH值在接近中性的条件下,因为它在不同pH值下的解离常数(pKa)大约在5.5左右。
MES通常与乙酸(CH3COOH)和NaOH(氢氧化钠)一起使用,形成所谓的MES缓冲液,用于控制溶液的pH值。MES缓冲液广泛应用于蛋白质的电泳、蛋白质的制备和纯化等领域,尤其是在需要在中性pH值条件下进行实验的情况下。
例如,在SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)中,MES缓冲液常被用作电泳缓冲液,以防止样品中的蛋白质在电泳过程中因pH变化而变性。此外,MES也用于一些蛋白质的等电聚焦和层析过程中,以维持特定的pH条件。
平衡缓冲液
储存条件:室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume Imidazole 30 mM 0.51 g PBS (Recipe 3) 1× 250 mL Adjust pH to 7.4 Total n/a 250 mL 注:Imidazole是一种有机化合物,分子式为C3H2N2。它在化学和生物化学中有着广泛的应用,特别是在金属离子螯合和缓冲液的制备中。Imidazole能够与多种金属离子形成稳定的螯合物,因此常被用作金属离子亲和色谱的配体,如在蛋白质纯化中常用的镍离子亲和色谱(Ni-NTA)。
Imidazole也是常用的pH缓冲剂,因为它在水溶液中的pKa值大约为6.07,这意味着它在接近中性的pH条件下能够提供稳定的pH环境。Imidazole缓冲液常用于蛋白质的变性和复性过程中,以控制反应过程中的pH值。
此外,Imidazole也存在于一些生物分子中,如DNA聚合酶和一些酶的活性位点中。在生物实验中,Imidazole有时会被用作酶的激活剂或抑制剂。
洗脱缓冲液
储存条件:室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume Imidazole 300 mM 2.04 g PBS (Recipe 3) 1× 100 mL Adjust pH to 7.4 Total n/a 100 mL Octet稀释缓冲液
储存条件:室温。稳定期至少一个月。
Reagent Final concentration Quantity or Volume BSA 0.1% (w/v) 50 mg PBS (Recipe 3) (or buffer that is compatible with the protein) 1× 50 mL Total n/a 50 mL 1%(w/v)含100 µg/mL氨苄西林、2 mM IPTG、40 µg/mL X-gal的琼脂LB平板
高压蒸汽灭菌后,在加入添加剂前冷却至55°C。在安全柜中倒置混合并倒入8.5厘米的培养皿中。在室温下冷却并凝固。储存条件:4°C,可储存两周。
Reagent Final concentration Quantity or Volume LB medium mix 25 g/L 6.25 g Bacto agar 1% (w/v) 2.5 g ddH2O n/a Make up to 250 mL Total n/a 250 mL Ampicillin (Recipe 16) 100 µg/mL 250 µL IPTG (Recipe 34) 2 mM 500 µL X-gal (20 mg/mL) 40 µg/mL 500 µL 34 mg/mL氯霉素
使用0.22 µm滤器进行无菌过滤。制备100 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Chloramphenicol 34 mg/mL 34 mg EtOH 100% 1 mL Total n/a 1 mL 50 mg/mL Spectinomycin
使用0.22 µm滤器进行无菌过滤。制备100 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Spectinomycin dihydrochloride pentahydrate 50 mg/mL 50 mg ddH2O n/a 1 mL Total n/a 1 mL 注:Spectinomycin dihydrochloride pentahydrate是一种抗生素,奇霉素,分子式为C22H41N5O11S·5H2O。它是一种广谱抗生素,对多种革兰氏阳性菌和革兰氏阴性菌都有抑制作用。Spectinomycin通常用于治疗由敏感细菌引起的感染,如尿路感染、呼吸道感染和皮肤感染等。
在本文中,Spectinomycin dihydrochloride pentahydrate可能被用作选择性抗生素,用于在含有抗氨苄青霉素抗性的TG1细胞中筛选纳米抗体克隆。通过在含有Spectinomycin的培养基上生长细胞,可以防止非抗性克隆的生长,从而选择性地获得含有抗氨苄青霉素抗性的重组噬菌体。
50 mg/mL 羧苄西林(Carbenicillin)
使用0.22 µm滤器进行无菌过滤。制备100 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Carbenicillin disodium salt 50 mg/mL 50 mg ddH2O n/a 1 mL Total n/a 1 mL 1%(w/v)含34 µg/mL氯霉素、50 µg/mL Spectinomycin、50 µg/mL羧苄西林的琼脂LB平板
高压蒸汽灭菌LB培养基和琼脂混合物,并在加入添加剂前冷却至55°C。在安全柜中倒置混合并倒入8.5厘米的培养皿中。在室温下冷却并凝固。储存条件:4°C,可储存两周。
Reagent Final concentration Quantity or Volume LB medium mix 25 g/L 2.5 g Bacto agar 1% (w/v) 1 g ddH2O n/a Make up to 100 mL Total n/a 100 mL Chloramphenicol (Recipe 41) 34 µg/mL 100 µL Spectinomycin (Recipe 42) 50 µg/mL 100 µL Carbenicillin (Recipe 43) 50 µg/mL 100 µL 0.2 M生物素
使用0.22 µm滤器进行无菌过滤。制备100 µL分装,储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Biotin 0.2 M 0.488 g NaOH (1 M) n/a Add to dissolve biotin ddH2O n/a Make up to 10 mL Total n/a 10 mL 含50 µg/mL Spectinomycin和50 µg/mL羧苄西林的Terrific broth
Prepare just before use in a safety cabinet.
Reagent Final concentration Quantity or Volume Terrific broth (Recipe 30) n/a 998 mL Spectinomycin (Recipe 42) 50 µg/mL 1 mL Carbenicillin (Recipe 43) 50 µg/mL 1 mL Total n/a 1 000 mL 1 mg/mL链霉亲和素Alexa FluorTM 488偶联物
避光保存,制备10 µL分装,并储存于-20°C。稳定期为六个月。
Reagent Final concentration Quantity or Volume Streptavidin Alexa FluorTM 488 conjugate 1 mg/mL 1 mg PBS (Recipe 3) 1× 1 mL Total n/a 1 mL 50 µg/mL链霉亲和素Alexa FluorTM 488偶联物
避光保存,使用前现配。
Reagent Final concentration Quantity or Volume Streptavidin Alexa FluorTM 488 conjugate (1 mg/mL) 50 µg/mL 1 µL PBS (Recipe 3) 1× 19 µL Total n/a 20 µL 500 mM TCEP, pH 8.0
储存条件:4°C。稳定期至少一个月。
Reagent Final concentration Quantity or Volume TCEP 500 mM 1.433 g ddH2O n/a 10 mL Adjust to pH 8.0 Total n/a 10 mL 注:TCEP代表三(2-羧乙基)膦(tris(2-carboxyethyl)phosphine),它是一种常用的化学还原剂,用于在蛋白质纯化过程中去除二硫键,从而使蛋白质变性并易于通过亲和层析进行纯化。TCEP能够有效地还原二硫键,是一种常用的蛋白质复性过程中的还原剂。
1 mM TCEP, pH 8.0
Prepare just before use.
Reagent Final concentration Quantity or Volume TCEP (Recipe 49) 1 mM 2 µL ddH2O n/a 998 µL Total n/a 1 mL 10 mg/mL Alexa FluorTM 647 C2-马来酰亚胺
避光保存并储存于-20°C。稳定期至少一年。
Reagent Final concentration Quantity or Volume Alexa FluorTM 647 C2-Maleimide 10 mg/mL 1 mg DMSO 1× 500 µL Total n/a 500 µL 注:Alexa FluorTM 647 C2-Maleimide是一种用于生物分子标记的荧光染料。它是一种化学偶联剂,可以与含有硫醇基团的分子(如蛋白质)共价结合。在本文中,Alexa FluorTM 647 C2-Maleimide被用来标记抗-Vimentin(VB3)纳米抗体,以便在HeLa细胞中进行荧光显微镜成像。通过与VB3纳米抗体上的自由巯基反应,Alexa FluorTM 647 C2-Maleimide可以将荧光染料共价结合到纳米抗体上,从而使得标记的纳米抗体能够在荧光显微镜下特异性地检测波形蛋白。
不含酚红的DMEM培养基,含10%(v/v)FBS,1× GlutaMAXTM,1×青霉素-链霉素
储存条件:4°C。稳定期至少一个月。
Reagent Final concentration Quantity or Volume DMEM medium n/a 88 mL FBS 10% (v/v) 10 mL GlutaMAXTM (100×) 1× 1 mL Penicillin-streptomycin (100×) 1× 1 mL Total n/a 100 mL Confocal 封闭/阻断 缓冲液
储存条件:4°C。使用期限为一个月内。
Reagent Final concentration Quantity or Volume PBS (Recipe 3) 1× 10 mL BSA 5% (w/v) 0.5 g Triton X-100 0.25% (v/v) 25 µL Total n/a 10 mL 共聚焦稀释缓冲液
储存条件:4°C。使用期限为一个月内。
Reagent Final concentration Quantity or Volume PBS (Recipe 3) 1× 10 mL BSA 1% (w/v) 0.1 g Triton X-100 0.25% (v/v) 25 µL Total n/a 10 mL
Laboratory supplies
Greiner Bio-One提供的Vacuette®管,4 mL,带有CAT血清凝血激活剂,血收集管,目录号:454204。
Greiner Bio-One提供的Vacuette®管,9 mL,NH钠肝素血收集管,目录号:455051。
Greiner Bio-One提供的微离心管,容量分别为0.5 mL、1.5 mL、2 mL,目录号分别为667201、616201、623201。
SARSTEDT提供的1.5 mL微离心管,RNase自由,目录号:72.706.700。
VWR提供的PCR管和盖子,目录号:20170-010。
Greiner Bio-One提供的50 mL锥形离心管,目录号:227261。
Greiner Bio-One提供的血清吸管,容量分别为2 mL、5 mL、10 mL、50 mL,目录号分别为710180、606180、607180、760180、768160。
SARSTEDT提供的螺旋盖微管,目录号:72.694.305。
BD提供的MicrolanceTM 3针头,21G,目录号:304432。
Greiner Bio-One提供的2.5 mL注射器,目录号:SYR2。
Greiner Bio-One提供的8.5 cm Petri盘,目录号:633181。
Mettler Toledo Ranin提供的过滤移液器尖,容量分别为20 µL、200 µL、1,000 µL,目录号分别为17005861、17005863、30389211。
Bio-Rad提供的Gene Pulser电穿孔杯,0.1 cm间隙,目录号:1652083。
Fisherbrand提供的聚苯乙烯半微杯,目录号:FB55147。
VWR提供的125 mL带挡板烧瓶,目录号:214-0458。
VWR提供的250 mL带挡板烧瓶,目录号:214-0460。
VWR提供的1 L带挡板烧瓶,目录号:214-0464。
Merck Hellma®提供的微石英吸收杯,目录号:Z600210。
Nunc提供的方形生物试验皿,目录号:240845。
VWR提供的非无菌试剂储存瓶,目录号:613-1176。
Axygen提供的无菌试剂储存瓶,目录号:RES-V-25-S。
Fisherbrand提供的深孔96孔2 mL板,目录号:11391555。
Greiner Bio-one提供的深孔96孔1 mL板,目录号:780215。
Greiner Bio-one提供的深孔96孔0.5 mL板,目录号:786261。
Azenta Life Sciences提供的细胞培养粘附密封,目录号:4ti-0517。
VWR提供的ELISA和一般培养用的粘附膜,目录号:60941-062。
Azenta Life Sciences提供的PCR箔密封,目录号:4ti-0550。
Thermo Scientific提供的刚性半裙式96孔PCR板,目录号:AB-0990。
Azenta Life Sciences提供的Framestar® 96孔带裙式PCR板,目录号:4ti-0960。
Greiner Bio-One提供的96孔ELISA微板,目录号:655061。
Sartorius提供的Octet SA生物传感器,目录号:18-5019。
Greiner Bio-One提供的96孔黑色聚丙烯板,目录号:655209。
Greiner Bio-One提供的96孔微孔板,目录号:65101。
Nalgene提供的250 mL PPCO离心管,目录号:3141-0250。
Nalgene提供的25 mL高速PPCO离心管,目录号:3119-0010。
Invitrogen提供的NuPage 4%–12% bis tris预制凝胶,目录号:NP0323BOX。可用的替代品是自制的12%运行和4%堆叠SDS-PAGE凝胶。
Agilent提供的0.22 μm注射器过滤器,目录号:5190-5116。
ibidi提供的µ-Slide 8-well高聚物底部凹槽盖玻片,目录号:80807。
Fisherbrand提供的带磨砂边缘的显微镜载玻片,目录号:11572203。
Scientific Laboratory supplies提供的12 mm直径,1.5号显微镜盖玻片,目录号:MIC3334。
Greiner Bio-One提供的6孔细胞培养皿,目录号:657160。
Electron Microscopy Sciences提供的Dumont镊子,型号5,目录号:0203-5-PS。
Ingetra提供的Pipetboy acu 2移液控制器,目录号:I155017。
Mettler Toledo Ranin提供的单通道移液器入门套件,目录号:30386738。
Mettler Toledo Ranin提供的多通道移液器,容量范围为1–10 µL, 20–200 µL, 100–1,200 µL,目录号分别为17013802, 17013805, 17014496。
Thermo Fisher提供的微板洗涤器(WellwashTM),目录号:5165000。如果没有微板洗涤器,可以使用多通道移液器或PBST填充的洗液瓶手动洗涤孔板。
BMG Labtech提供的CLARIOstar plus微孔板读取器,目录号:430-501S-FL。
Contained Air solutions提供的二级生物安全柜(也称为安全柜,即层流柜),目录号:BioMAT 2。如果没有安全柜,使用 Bunsen 燃烧器是合适的替代方案。使用易燃乙醇的开放式火焰应小心进行。
Bigneat提供的PCR工作站柜,目录号:MW520-20。
Thermo Scientific提供的NanoDropTM One/OneC微体积UV-Vis分光光度计,目录号:ND-ONE-W。
Invitrogen提供的DynaMagTM 96侧磁铁,目录号:12331D。
Applied Biosystems提供的PCR热循环器(VeritiTM),目录号:4375305。
Eppendorf提供的Eporator,目录号:4309000027。
Bio-Rad提供的ChemiDocTM成像系统,目录号:12003154。
Fisherbrand提供的细胞密度计,目录号:A0。
Flowgen提供的多子电泳系统,目录号:FMMS10。
Invitrogen提供的SDS-PAGE设备,迷你胶槽,目录号:A25977。
Bio-Rad提供的PowerPac基本电源,目录号:1645050EDU。
Grant提供的JB Nova水浴,目录号:JBN5。
Grant提供的干热块,目录号:QBD2。
Thermo Fisher提供的双LED蓝光/白光透射器,目录号:LB0100。
Thermo Fisher提供的Safe ImagerTM观察眼镜,目录号:S37103。
Invitrogen提供的HulaMixerTM样本混合器,目录号:15920D。使用该样本混合器进行振荡的设置如下:轨道 = 5,转速 = 1。
Invitrogen提供的DynaMagTM-2磁铁,目录号:12321D。
Corning提供的LSETM数字微孔板振荡器,目录号:4782-4。使用微孔板振荡器进行振荡的转速为500 rpm。
Thermo Scientific提供的Multifuge X4 Pro-MD离心机,目录号:75009500。在所有离心步骤中,除非另有说明,否则使用最大加速度和减速度率。
Thermo Scientific提供的FrescoTM 21微离心机,目录号:75002555。
Shel Lab提供的Orbital shaking incubator,目录号:SI6/SI6R(用于600 rpm振荡步骤)。
New Brunswick提供的44R incubator shaker(Innova®型号),目录号:M1282-0006(用于200和250 rpm振荡步骤)。
Sartorius提供的Octet® R8生物传感器,目录号:30-0518。
Leica Microsystems Ltd.提供的SP8 Lightning共聚焦显微镜。
Thermo Scientific提供的HeracellTM VIOS 160i CO2培养箱,目录号:51033559。
Cole-Parmer提供的StuartTM SSM3摇床,目录号:51900-26。
Software and datasets
- SnapGene软件(版本7.1.0,2023年发布,2023年11月28日发布),需要许可证。
- Octet® Analysis Studio软件(版本12.2.2.26),需要许可证。
- 共聚焦显微镜的LasX软件(版本5.2.1),需要许可证。
Procedure
羊驼免疫
通过肌肉内免疫的方式在骆马中产生抗体,可同时平行免疫多达八种不同的蛋白质。蛋白质的种类取决于预期的应用。我们已经通过这种方式产生了针对整合膜蛋白(例如PEPT2[4])、细胞表面糖蛋白(例如GPC3[7])和病毒抗原(例如SARS-CoV-2刺突蛋白[6])的纳米抗体。
- 将蛋白质抗原储存在-80°C,每个分装3 × 200 µg,最好是以200 µL的1 mg/mL浓度分装,使用PBS或对蛋白质最佳的缓冲液(例如,如果蛋白质是使用去垢剂溶解的膜蛋白,则应在缓冲液中加入适当去垢剂的所需量)。
- 免疫前,收集5 mL不含抗凝剂的血液,以便制备免疫前的血清样本。免疫前血清样本的制备方法详见步骤C2。
- 免疫当天,先将每个要用于免疫的蛋白质分装解冻。轻轻将每种蛋白质与等体积的Gerbu佐剂混合,然后皮下注射(每个部位最多2 mL)。
- 骆马在免疫当天(第0天)进行免疫,随后在第28天和第56天给予两次抗原加强免疫。在最后一次加强免疫后10天,从颈静脉收集170 mL血液到含肝素的管中(以防止凝固),用于分离多形核细胞(PMNCs)。此外,还要收集5 mL不含抗凝剂的血液,用于制备免疫后的血清样本。免疫后血清样本的制备方法详见步骤C2。
血清转换ELISA
血清转换ELISA的目的是确认羊驼免疫是否成功产生了对注射抗原的反应。强烈的ELISA信号强烈提示可以通过噬菌体展示从创建的库中分离出结合纳米抗体。
使用100 µL/孔的10 µg/mL中性亲和素TM稀释液(PBS稀释)对96孔ELISA微板进行包被,并在4°C下过夜。
- 使用板洗涤器,用300 µL/孔的PBST洗涤板5次。
- 向每孔中加入100 µL/孔的50 nM生物素化目标蛋白稀释液(PBS稀释),并在室温(RT)下摇板孵育1小时。参见一般注释1。
- 使用板洗涤器,用300 µL/孔的PBST洗涤板5次。
- 向每孔中加入250 µL/孔的封闭溶液,并在室温(RT)下摇板孵育1小时。
- 使用板洗涤器,用300 µL/孔的PBST洗涤板5次。
- 将110 µL的免疫前或免疫后血清(1:10稀释于封闭溶液中)加入96孔板的第一孔中。
- 在板的第二个孔中加入100 µL的封闭溶液,并将10 µL溶液从第一个孔中加入。对第三个孔重复此操作,使血清分别稀释为1:10、1:100和1:1000;包括无血清对照。在室温(RT)下摇板孵育1小时。
- 使用板洗涤器,用300 µL/孔的PBST洗涤板5次。
- 向每孔中加入100 µL/孔的抗骆马-HRP稀释液(0.1% BSA-PBS稀释,1:2500),并在室温(RT)下摇板孵育1小时。
- 使用板洗涤器,用300 µL/孔的PBST洗涤板5次。
- 向每孔中加入100 µL/孔的ABTS底物,通过等体积混合A液和B液制备。避光,并在15分钟后测量405 nm处的吸光度。参见一般注释2。
VHH库的准备
下面(表1)是准备VHH库所需的实验建议时间表。协议可以中断/暂停的实例由“pause point”标出。
Table 1. VHH库制备实验时间表
| Task 1 | Task 2 | Task 3 | |
|---|---|---|---|
| Day 1 | 分离PMNCs(步骤C1) | 分离免疫血清(步骤C2) | RNA提取(步骤C3a–g)暂停点 |
| Day 2 | RNA提取(步骤C3h–i) | VHH1的反转录和PCR扩增(步骤C4) | 生产VHH2(步骤C5)暂停点 |
| Day 3 | 消化pADL23c(步骤C6)暂停点 | ||
| Day 4 | 库大小测试(步骤C7a–g) | ||
| 库大小测试(步骤C7h–n)暂停点 | |||
| Day 6 | 按比例扩大库的准备(步骤C8a–i) | ||
| Day 7 | 按比例扩大库的准备(步骤C8j)暂停点 |
PMNCs的分离
以下说明基于收到170 mL无抗凝剂的骆马血液,分装在17个10 mL的血液试管中。PMNCs的分离应在采血当天进行。所有工作都在安全柜内进行,先用5%的Chemgene喷洒,然后用70%的乙醇消毒。
注意事项: 使用2%的Virkon消毒所有血液污染的消耗品和液体,然后进行高压蒸汽灭菌。使用10 mL血清吸管,将2个10 mL血液试管中的血液转移到1个50 mL锥形离心管中。
向每个空血液试管中加入10 mL PBS,然后将这些试管中的液体转移到含有20 mL血液的锥形离心管中(步骤C1a),使每个50 mL锥形离心管中的稀释血液体积达到40 mL,总共340 mL的稀释血液。轻轻倒转试管以确保混合均匀。
在新的23 × 50 mL锥形离心管中,加入15 mL Histopaque®-1077,然后轻轻地将15 mL稀释血液覆盖在其上方。参见一般注释3。在添加血液时,使试管与水平面呈45°角。参见一般注释4。
关键点: 此时避免摇晃试管,以保持正在形成的密度梯度。在18°C下,使用加速= 1和减速= 0,以800× g离心20分钟。
关键点: 加速和减速率非常重要,因为它们将创建并维持所需的梯度。密度梯度和PMNC层的定位如图1所示。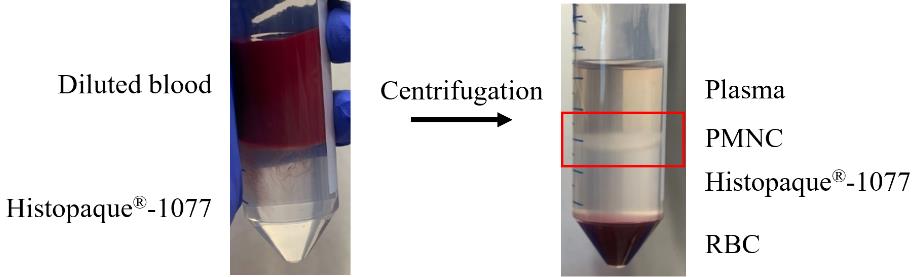
从23个准备好的血液-Histopaque®-1077试管中,收集位于血浆-Histopaque®-1077界面处的PMNC层(图1中的红色方框)。这可以通过使用25 mL血清吸管并在界面上方放置来实现,同时移动吸管表面,吸取液体。吸取的PMNCs中任何夹带的Histopaque®-1077或血清将在接下来的步骤中被洗掉。
将2个离心管 worth 的分离PMNCs转移到一个50 mL的锥形离心管中。通常,每个锥形离心管可以回收15-20 mL的PMNCs。如果收集更多,请确保将20 mL的分离PMNCs添加到新鲜的50 mL锥形离心管中。此时应准备23至25个50 mL锥形离心管。
向每个含有分离PMNCs的锥形离心管中加入PBS,使总体积达到40 mL。可以直接从PBS瓶中倾倒,只要不接触锥形离心管即可。轻轻倒转锥形离心管几次,并在18°C下以250× g离心10分钟。
倾出上清液,并使用新的5 mL血清吸管,对每个锥形离心管中的沉淀物用5 mL PBS轻轻重悬。在18°C下以100× g离心5分钟。
注意:此时开始使用RNaseZapTM擦拭工作表面、手套和带入安全柜的任何物品。使用5 mL血清吸管从每个50 mL锥形离心管中移除上清液。使用2 mL血清吸管,将三个锥形离心管中的沉淀物共1 mL PBS轻轻重悬到一个50 mL锥形离心管中。使用这个血清吸管中的最后一点液体,将其分配到一个1.5 mL微离心管中。此时应有六个50 mL锥形离心管和六个1.5 mL微离心管。
从安全柜中取出六个1.5 mL微离心管。在每个1.5 mL微离心管的盖子上,加入20 µL细胞和20 µL Trypan蓝,并轻轻混合。使用自动细胞计数器确定细胞数量和活力。每个从锥形离心管中取样的样本应含有大约1×107个细胞,活力为98%–100%。因此,总产量应为6×107个细胞。参见一般注释5。
注意:以下步骤可以在实验室台面或PCR安全柜中进行,前提是台面或安全柜被RNaseZapTM喷洒过,并且使用RNase-free的尖头和1.5 mL微离心管。将每个50 mL锥形离心管中的细胞悬浮液(步骤C1i)转移到各自的1.5 mL微离心管中。总共有六个1.5 mL微离心管。在4°C下以100× g离心5分钟。弃去上清液。现在可以从沉淀物中提取RNA(步骤C3a)。
关键点:立即执行RNA提取(步骤C3)。
免疫前和免疫后血清的分离
血清必须在采血当天分离。这些步骤可以在分离PMNCs时在实验室台面上完成。
- 在室温(RT)下 incubate 凝结的血液 30 分钟。
- 使用 2 mL 血清吸管在血液凝块上刺孔,并使用 stripette 引导凝块和血清进入一个 50 mL 锥形离心管中。在 4°C 下以 1,000× g 的速度离心 10 分钟。
- 将血清转移到一个 15 mL 锥形离心管中。可能需要进行第二次离心,在 4°C 下以 1,000× g 的速度离心 10 分钟,以获得清澈的血清。在旋盖微管中制备血清的 500 µL 样本,然后储存于 -20°C。
RNA提取
*注意:所有工作应在实验室台面或PCR安全柜中进行,此前应在表面喷洒RNaseZapTM。使用RNase-free消耗品,并在手套上喷洒RNaseZapTM。参见一般注释6。
- 在每个1.5 mL微离心管中的六个细胞沉淀物(步骤C1k)中,加入1 mL冷TRIzolTM试剂。使用21 G针头和2.5 mL注射器,通过针头抽取和排放十次,使每个1.5 mL微离心管中的内容物均匀化。
注意事项: 使用针头时请小心。 - 在冰上孵育 resulting lysate 5分钟,以允许核蛋白复合物完全解离,然后在每个1.5 mL微离心管中加入0.2 mL氯仿。
- 剧烈振荡每个微离心管约10秒。应该形成均匀的粉红色乳状溶液。在冰上孵育3分钟,然后在4°C下以12,000× g 的速度离心15分钟。混合物分离成下层红色酚-氯仿层、中间层和无色上层水相。如果上层水相仍然浑浊或未形成良好,请再次振荡和离心。
- 使用200 µL移液器,将大约500 µL的上层水相(包含RNA)转移到一个新的1.5 mL微离心管中。确保留下一些上层水相,以确保不包含中间层的沉淀物。加入0.5 mL异丙醇,轻轻倒转每个管几次,并在冰上孵育10分钟。
- 在4°C下以12,000× g 的速度离心10分钟,以沉淀RNA。在离心机的旋转过程中,将1.5 mL微离心管的盖子朝外,以便在离心后更容易看到白色胶状沉淀。使用200 µL移液器移除大约900 µL的含有异丙醇的上清液,确保沉淀不被扰动或意外吸入废物中。
- 在1.5 mL微离心管中加入1 mL 75%乙醇,振荡 briefly,然后在4°C下以7,500× g 的速度离心5分钟。RNA沉淀看起来比前一步骤结束时略白且略大。使用200 µL移液器移除大约900 µL的上清液,确保沉淀不被扰动或意外吸入。
- 加入1 mL 75%乙醇,并将纯化的RNA储存于 -20°C。参见一般注释7。
暂停点。 - 从 -20°C 取出一个微离心管的RNA,并在4°C下以7,500× g 的速度离心5分钟。使用200 µL和10 µL移液器弃去乙醇,确保不意外吸入沉淀。在室温(RT)下干燥10分钟。
- 使用无核酸酶水溶解RNA沉淀,并用Nanodrop测量A260。期望浓度在500至800 ng/µL之间,A260/280和A260/230的值均约为2.0。
关键点: 使用RNase-free尖头和移液器从PCR安全柜中测量RNA浓度,以避免从公共尖头和移液器中引入RNases。一旦RNA被分离,尽快进行步骤C4,以产生cDNA,其稳定性优于RNA。
- 在每个1.5 mL微离心管中的六个细胞沉淀物(步骤C1k)中,加入1 mL冷TRIzolTM试剂。使用21 G针头和2.5 mL注射器,通过针头抽取和排放十次,使每个1.5 mL微离心管中的内容物均匀化。
反转录和PCR扩增VHH1
*注意:在实验室台面或PCR安全柜中进行工作,此前应在表面喷洒RNaseZapTM。使用RNase-free消耗品,并在手套上喷洒RNaseZapTM。参见一般注释6。
在一个PCR管(1 × 50 µL)中准备以下反应(表2)。
Table 2. PCR reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 9.5 µL 10 µM CALL 001 primer 0.5 µM 2.5 µL 10 µM CALL 002 primer 0.5 µM 2.5 µL 2× PlatinumTM SuperFiTM RT-PCR Master Mix 1× 25 µL 1 µg Template RNA (step C3i) 200 ng 10 µL SuperScriptTM IV RT Mix 0.5 µL Total n/a 50 µL 短暂振荡并离心反应管,然后放在冰上。
按照以下设置设置热循环器并执行PCR(表3)。
Table 3. PCR cycling conditions
Step Temperature (°C) Duration Number of cycles Reverse transcription 55 10 min 1 Reverse transcription inactivation/initial denaturation 98 2 min Denaturation 98 10 s 30 Annealing 66 10 s Extension 72 30 s Final extension 72 5 min 1 Hold 12 Infinite hold - 注意:从这一点开始,没有必要保持RNase-free条件。在实验室台面上进行工作。
将50 µL的6× DNA凝胶加载缓冲液加入反应管中,并在含有1× SYBRTM Safe DNA凝胶染料的0.7%琼脂糖凝胶上电泳,与1× GeneRuler 1 kb DNA梯度一起运行。在1× TBE缓冲液中以80 V电泳40分钟。
使用LED蓝光透射器可视化扩增的700 bp片段(VHH-CH2),并用手术刀从凝胶中切出该片段,然后使用Nucleospin Gel和PCR清洁试剂盒根据制造商的协议进行凝胶提取。最后用NE缓冲液洗脱,最终体积为50 µL。注意事项: 在从琼脂糖凝胶中切割DNA条带时使用Safe ImagerTM观察眼镜,并在使用手术刀时小心。
使用Purelink PCR纯化试剂盒,将4×体积的B2缓冲液(200 µL)加入凝胶提取的产品中,并通过Purelink PCR纯化试剂盒中的一个柱子进行纯化,使用25 µL E1缓冲液洗脱。测量A280,并期望浓度约为40–50 ng/µL。
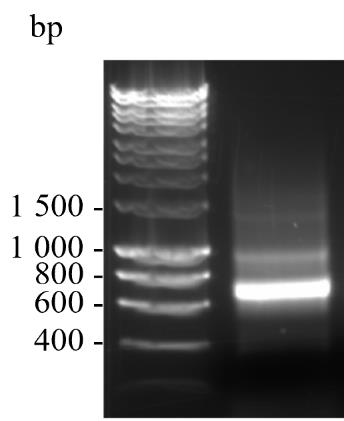
将6× DNA凝胶loading缓冲液与120 ng的VHH1(步骤C4f)混合,最终浓度为1×,并在含有1× SYBRTM Safe DNA凝胶染料的1%琼脂糖凝胶上电泳,与1× HyperLadderTM 1 kb DNA梯度一起运行,以确定纯度。在1× TBE缓冲液中以80 V电泳40分钟。结果如图2所示。
VHH2的制作
在PCR管中准备以下PCR反应(6 × 50 µL反应)(表4)。表4. PCR反应组成
Table 4. PCR reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 19 µL 10 µM VHH For2 primer 0.5 µM 2.5 µL 10 µM VHH Rev primer 0.5 µM 2.5 µL 2× Phusion flash PCR master mix 1× 25 µL 5 ng/µL VHH1 (step C4f) 1 ng 10 µL Total n/a 50 µL 短暂振荡并离心反应管。
按照以下设置设置热循环器并执行PCR(表5)。表5. PCR循环条件
Table 5. PCR cycling conditions
Step Temperature (°C) Duration Number of cycles Denaturation 98 30 s 1 Annealing 98 10 s 30 Extension 55 30 s Final extension 72 20 s Hold 72 5 min 1 Denaturation 12 Infinite hold - 将所有六个反应合并到一个2 mL微离心管中。使用Purelink PCR纯化试剂盒,向扩增的PCR产物中加入4×体积的B2缓冲液(1.2 mL)并在两个Purelink柱子之间进行纯化,每个柱子用25 µL的E1缓冲液洗脱。将两个洗脱液合并到一个1.5 mL微离心管中,测量A280,并期望浓度在200至300 ng/µL之间。
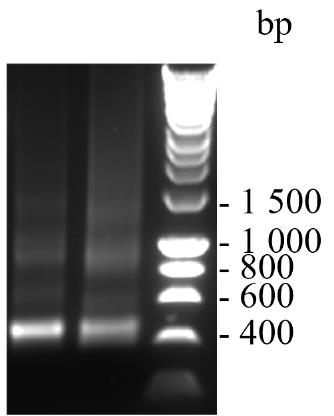
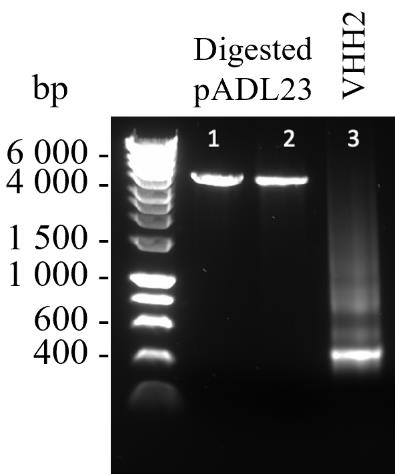
将6× DNA凝胶加载缓冲液与120 ng的VHH2(步骤C5d)混合,最终浓度为1×,并在含有1× SYBRTM Safe DNA凝胶染料的1%琼脂糖凝胶上电泳,与1× HyperLadderTM 1 kb DNA梯度一起运行,以确定纯度。在1× TBE缓冲液中以80 V电泳40分钟。结果如图3所示。
Pause point.
pADL23c的消化
在PCR管中准备以下限制消化反应(10 × 100 µL反应)(表6)。表6. 限制消化反应组成
Table 6. Restriction digestion reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 83 µL rCutSmartTM 缓冲液 1× 10 µL SfiI限制性内切酶 5 units 2.5 µL 400 ng/µL vector DNA 1.8 µg 4.5 µL Total n/a 100 µL 短暂轻微振荡并离心反应管。
在50°C下孵育2小时。
向每个反应管中加入20 µL的6× DNA凝胶加载缓冲液,并在含有1× SYBRTM Safe DNA凝胶染料的0.7%琼脂糖凝胶上电泳,与1× GeneRuler 1 kb DNA梯度一起运行。在1× TBE缓冲液中以80 V电泳40分钟。结果如图4所示。
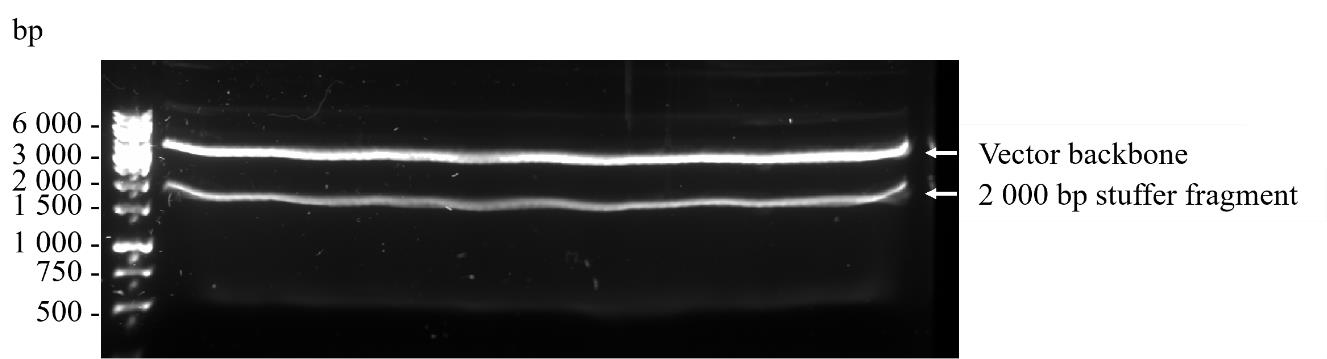
使用LED蓝光透射器可视化消化后的、高分子量的大约3000 bp的载体骨架,并用手术刀从凝胶中切出该片段,然后使用Nucleospin Gel和PCR清洁试剂盒根据制造商的协议进行凝胶提取。每个柱子使用50 µL NE缓冲液洗脱,并将所有洗脱液合并到单个1.5 mL微离心管中。注意事项: 在从琼脂糖凝胶中切割DNA条带时使用Safe ImagerTM观察眼镜,并在使用手术刀时小心。
使用Purelink PCR纯化试剂盒,向凝胶提取的产品中加入4×体积的B3缓冲液(2 mL)并使用Purelink PCR纯化试剂盒中的一个柱子进行纯化,使用50 µL E1缓冲液洗脱。测量A280,并期望浓度在50至80 ng/µL之间。
将6× DNA凝胶加载缓冲液与120 ng的VHH2(步骤C5d)混合,并将pADL23c载体骨架(步骤C6f)消化至最终浓度为1×,然后与1× HyperLadderTM 1 kb DNA梯度一起在含有1× SYBRTM Safe DNA凝胶染料的1%琼脂糖凝胶上电泳,以确定纯度。在1× TBE缓冲液中以80 V电泳40分钟。期望结果如图5所示。暂停点。这个暂停点意味着实验流程在这里可以暂时停止,以便于进行其他准备工作或等待结果。在继续之前,可能需要检查纯化产物的质量,或者准备好下一步所需的材料和设备。
库大小测试
在一个PCR管(1 × 10 µL)中准备以下融合反应(表7)。表7. PCR反应组成
Table 7. PCR reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 5 µL 5× CEII buffer 1× 2 µL 100 ng/µL VHH2 insert (step C5d) 100 ng 1 µL 20 ng/µL vector DNA (step C6f) 20 ng 1 µL Exnase II 1 µL Total n/a 10 µL 短暂振荡并离心反应管。
在热循环器中,于42°C孵育30分钟。向反应管中加入40 µL TE缓冲液以终止反应。
使用Purelink PCR纯化试剂盒,向融合产物中加入4×体积的B3缓冲液(200 µL)并使用Purelink柱子进行纯化,用无核酸酶水(20 µL)洗脱。注意: 在安全柜内操作。
在一个1.5 mL微离心管中,将5 µL纯化的融合反应轻轻混合30 µL competent TG1,并转移到一个冷却的1 mL电穿孔杯中。
在电穿孔杯中电穿孔1.7 kV,立即向杯中加入400 µL恢复培养基。将内容物转移到一个2 mL微离心管中,并在37°C下振荡(600 rpm)孵育1小时。参见一般注释8。
使用50 µL培养基,制备2× YT中的1:10、1:100和1:1000的稀释液。将100 µL涂布在含100 µg/mL氨苄西林的1%琼脂LB平板上,直至干燥。在37°C下过夜孵育。
使用以下公式估计文库的大小,以每毫升菌落形成单位(CFU/mL)表示:菌落数 × 10(转换为mL)× 0.4(体积)× 稀释倍数。参见一般注释9。
根据估计的小规模文的大小,设置所需的反应数量,考虑到5 µL的融合反应产生了×大小的库。计算需要多少微升的融合反应才能制备一个大小为1 × 106的库。参见一般注释10。
为验证小规模文库中全长VHH克隆的数量,对从步骤C7g的平板上随机选择的48个克隆进行菌落PCR,扩增约500 bp的VHH基因。在一个2 mL微离心管中准备以下PCR反应母液(表8)。表8. PCR反应组成
Table 8. PCR reaction composition
Reagent Final concentration Volume for single reaction Volume for master mixture Nuclease-free water n/a 20.75 µL 1037.5 µL 10 µM PhD seq Fwd primer 0.2 µM 0.5 µL 25 µL 10 µM PhD seq Rev primer 0.2 µM 0.5 µL 25 µL 10× Taq buffer 1× 2.5 µL 125 µL 25 mM dNTP 0.25 mM 0.25 µL 12.5 µL Taq polymerase 1 unit 0.5 µL 25 µL Total n/a 25 µL 1250 µL 短暂振荡并离心反应管。
使用48个× 10 µL尖端的移液器,将25 µL的母液分配到96孔刚性半裙式PCR板的48个孔中。用48个尖端分别取48个菌落,放入每个已加液的孔中。使用多通道移液器移除尖端。用PCR箔密封覆盖PCR板。
按照以下设置设置热循环器并执行PCR(表9)。表9. PCR循环条件
Table 9. PCR cycling conditions
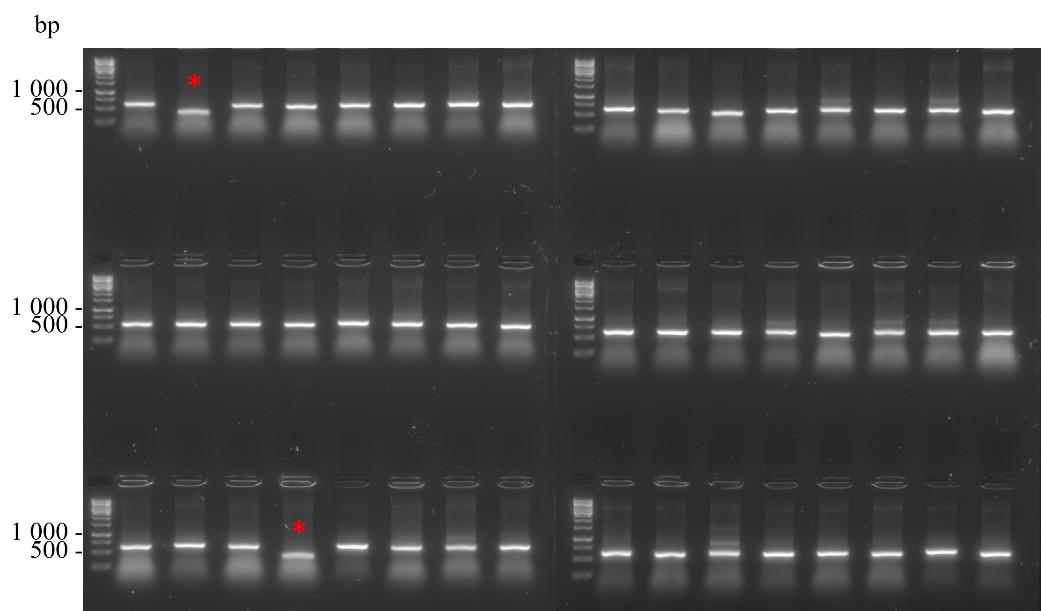
Step Temperature (°C) Duration Number of cycles Denaturation 95 7 min s 1 Annealing 95 15 s 35 Extension 55 30 s Final extension 68 1 min 40 s Hold 68 5 min 1 Denaturation 12 Infinite hold - 向PCR板每个孔中添加20 µL的2× DNA凝胶加载缓冲液,并将10 µL加载到每个孔中,与1× GeneRuler 1 kb DNA梯度一起在含有1× SYBRTM Safe DNA凝胶染料的1%琼脂糖凝胶上电泳。在1× TBE缓冲液中以80 V电泳40分钟。在图6中,46个经过菌落PCR的克隆中有大约500 bp的带,对应于扩增的VHH基因。两个呈阳性的克隆由星号标记。
Pause point.
放大文库的准备
在PCR管中准备以下反应(20 × 20 µL)(表10)。表10. In-Fusion反应组成
Table 10. In-Fusion reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 9 µL 5× CEII buffer 1× 4 µL 50 ng/µL VHH2 insert (step C5c) 100 ng 2 µL 5 ng/µL vector DNA (step C6f) 20 ng 4 µL Exnase II 1 µL Total n/a 20 µL 短暂振荡并离心反应管。
在热循环器中,于42°C孵育30分钟。
将反应合并到单个2 mL微离心管中。使用Purelink PCR纯化试剂盒,向融合产物中加入4×体积的B3缓冲液(1.6 mL)并使用Purelink柱子进行纯化,用无核酸酶水(50 µL)洗脱。测量A280,并期望浓度在35至50 ng/µL之间。注意: 在安全柜内操作。
通过电穿孔分别转化TG1细胞来创建放大文库。在一个1.5 mL微离心管中,轻轻混合6 µL纯化的融合反应和30 µL competent TG1,并转移到一个冷却的1 mL电穿孔杯中。在1.7 kV下电穿孔,立即向杯中加入960 µL恢复培养基,并转移到一个50 mL锥形离心管中。参见一般注释8。
重复此步骤共八次,使用八种独立的融合-TG1混合物。
将两个电穿孔杯中的细胞合并到单个50 mL锥形离心管中,并在37°C下振荡(200 rpm)孵育1小时。总共有四个锥形离心管。
从其中一个锥形离心管中取50 µL,制备2× YT中的1:10、1:100和1:1000的稀释液。将每个稀释液的100 µL涂布在含100 µg/mL氨苄西林的1%琼脂LB平板上,直至干燥。在37°C下过夜孵育。使用这些平板估计文的大小(CFU/mL)= 菌落数 × 10(转换为mL)× 1.92(体积)× 稀释倍数。参见一般注释9。
将每个锥形离心管中的整个培养物分别涂布在含有100 µg/mL氨苄西林的2%琼脂LB平板上。总共有四个平板。将培养物涂布至干燥,并在37°C下过夜孵育。期望的密度与图7所示相似,相当于一个大小为1 × 106 CFU/mL的文库。参见一般注释11。

[^图7.]: 1 × 10^6 CFU/mL库在生物试验板上的预期密度
将每个生物试验板上的菌落涂层在6 mL的2× YT(最终含有25%甘油)中重新悬浮,并转移到一个单独的50 mL锥形离心管中。通过血清吸管充分混合,并在旋盖微管中制备1 mL的样本,储存于 -80 °C。这是VHH文库的库存,用于第一轮筛选。
暂停点。
筛选
以下是筛选、ELISA检测和小规模表达的建议时间表,以最大限度地利用实验室时间,并允许在多人对多个蛋白质进行筛选活动时,如果有多个筛选活动共享资源,可以有重叠(表11)。
表11. 通过筛选、ELISA和小规模表达识别纳米抗体结合者的实验时间表
Table 11. Experimental timetable for the identification of nanobody binders through panning, ELISA, and small-scale expression
| Monday | Tuesday | Wednesday | Thursday | Friday | |
|---|---|---|---|---|---|
| Week 1 | 放大VHH文库(步骤D3) | 回收文库噬菌体(步骤D3)第一轮筛选(步骤D4) | 回收菌落涂层(步骤D4)放大子文库(步骤D5) | 回收子文库噬菌体(步骤D5)第二轮筛选(步骤D6) | 将平板从培养箱取出并放入冰箱。 |
| Week 2 | 挑取93个克隆并过夜培养(步骤D7) | 准备主板(步骤D7)开始制备抗M13 ELISA(步骤D8) | 抗M13 ELISA(步骤D8) | PCR、清洁、测序(步骤D9) | |
| Week 3 | 小规模过夜培养(步骤E1) | 小规模培养至OD并诱导IPTG(步骤E1) | 外膜分离(步骤E1)Ni-NTA纯化(步骤E2)脱盐(步骤E3) | 滴定ELISA(步骤E4)解离速率确定(步骤E5) |
准备对数生长期的TG1菌株. 注意事项: 在安全柜内操作
- 在不含抗生素的1%琼脂LB平板上划线接种TG1菌株,并在37°C下过夜培养。
- 在一个100 mL的一次性挡板Erlenmeyer烧瓶中,接种20 mL的2× YT培养基,加入单个TG1菌落,并在37°C下振荡培养过夜(200 rpm)。
- 将20 mL的50%甘油与过夜培养物混合,并在-80°C下分装成1 mL的样本。这是TG1库存,在需要时用于制备对数生长期的TG1培养物。
- 在一个125 mL的一次性挡板Erlenmeyer烧瓶中,向25 mL的2× YT培养基中加入足够的TG1库存(步骤D1c),使起始OD600约为0.05。参见一般注释12。
- 在37°C下振荡培养TG1培养物(200 rpm),直到OD600达到0.4–0.6。这大约需要1.5–2小时。这是对数生长期的TG1,应保持在冰上,并在2小时内使用。
准备CM13K助噬菌体注意事项: 噬菌体可以感染所有细菌。如果在蛋白质表达实验室工作,必须小心不要将噬菌体释放到公共区域。如果表面容易腐蚀,请用5%的Chemgene擦拭后用70%的乙醇消毒。鼓励使用过滤尖头以减少气溶胶。所有被污染的消耗品必须用2%的Virkon消毒并高压蒸汽灭菌。
如果可能,请为步骤D1–D5中概述的所有培养物使用一次性Erlenmeyer烧瓶。注意事项: 在安全柜内操作。
- 在一个125 mL的一次性挡板Erlenmeyer烧瓶中,接种20 mL的2× YT培养基,加入200 µL的对数生长期TG1(步骤D1e),并在37°C下振荡培养4小时(250 rpm)。
- 在两个1 L的一次性挡板Erlenmeyer烧瓶中,分别加入250 mL的2× YT培养基(含25 µg/mL卡那霉素)和10 mL已制备的培养物。在25°C下振荡培养过夜(250 rpm)。
- 在4,500× g下离心10分钟(4°C),并将大约170 mL的含噬菌体上清液转移到三个250 mL的PPCO离心管中。向每个管中加入约35 mL的冰冷PEG/NaCl,颠倒并轻轻摇动,使PEG/NaCl溶液与噬菌体上清液混合。在冰上孵育1小时。
- 在4°C下以12,000× g离心15分钟,并将三个沉淀分别悬浮在4 mL的冰冷无菌PBS中。将悬浮的沉淀合并到一个25 mL的高速PPCO离心管中,并加入2.5 mL的冰冷PEG/NaCl。轻轻摇动并颠倒,使PEG/NaCl溶液与噬菌体上清液混合。在冰上孵育30分钟。
- 在4°C下以12,000× g离心10分钟,并将沉淀悬浮在12 mL的冰冷无菌PBS中。保持在4°C,直到噬菌体浓度,以每毫升斑点形成单位(PFU/mL)表示,通过分光光度法或斑点试验确定,这两种方法应该给出相似的值。
- 对于噬菌体浓度的分光光度法测定,在一个1.5 mL的微离心管中,加入998 µL的PBS和2 µL的噬菌体(步骤D2e),转移到石英比色杯中,并在268 nm处测量吸光度。考虑到A268为1.0相当于5 × 1012 PFU/mL [11]。
- 对于噬菌体浓度的斑点试验测定,制备CM13K助噬菌体的十倍系列稀释(10^-1至10^-25)在TG1对数生长期(步骤D1e)中,并在室温下孵育5分钟。将100 µL的10^-15至10^-25稀释液涂布在无抗生素的1%琼脂LB平板上。每块平板上添加3 mL的0.7%琼脂LB(55°C),并摇动整个平板表面。让顶层琼脂固化,并在37°C下过夜培养。使用以下公式计算PFU/mL:斑点数(清晰区域)× 10(转换为mL)× 稀释倍数。
- 将CM13K助噬菌体(步骤D2e)稀释至2 × 10^13 PFU/mL,使用冰冷的无菌PBS,加入等体积的冰冷50%甘油,并轻轻混合,使最终浓度为1 × 10^13 PFU/mL。在500 µL的微离心管中分装成100 µL的样本。这是CM13K助噬菌体的库存。每次解冻一个新的100 µL样本时,将其中的12 µL分装到9个PCR管中,以避免对原始100 µL样本进行冻融。
扩增和回收文库
注意:在安全柜内操作。
- 在一个250 mL的一次性挡板Erlenmeyer烧瓶中,向50 mL的2× YT培养基中加入足够的VHH库库存(步骤C8j),使起始OD600约为0.05。参见一般注释13。
- 在37°C下振荡培养该培养物(200 rpm),直到OD600达到0.4–0.6。这大约需要2小时。参见一般注释14。
- 将10 mL此培养物转移到一个50 mL锥形离心管中,加入10 µL的CM13K助噬菌体库存(步骤D2h),并通过轻轻摇动混合。在37°C下孵育1小时,不进行搅拌。
- 在18°C下以2,800× g离心10分钟,将沉淀重新悬浮在50 mL的2× YT培养基中(含100 µg/mL氨苄西林和25 µg/mL卡那霉素),并转移到一个250 mL的一次性挡板Erlenmeyer烧瓶中。在25°C下振荡培养过夜(250 rpm)。
- 将过夜培养物转移到一个50 mL锥形离心管中,并在4°C下以3,200× g离心10分钟。
- 将40 mL含噬菌体的上清液转移到一个新的50 mL锥形离心管中,并加入10 mL冰冷的PEG/NaCl。颠倒几次,并在冰上孵育1小时。
- 在4°C下以3,200× g离心10分钟,沉淀噬菌体。将噬菌体在1 mL冰冷的无菌PBS中重新悬浮,并转移到一个2 mL的微离心管中。
- 在4°C下以20,000× g离心1分钟,将上清液转移到一个新的2 mL微离心管中。加入250 µL冰冷的PEG/NaCl,颠倒试管,直到形成均匀的白色悬浮液。在冰上孵育30分钟。
- 在4°C下以20,000× g离心15分钟,沉淀噬菌体。将沉淀的噬菌体在1 mL冰冷的无菌PBS中重新悬浮,并转移到一个2 mL的微离心管中。
- 最后,在4°C下以20,000× g离心1分钟,将上清液转移到一个新的2 mL微离心管中。这是分离的库噬菌体;它可以保持冰上或4°C,稳定期为一个月。
- 使用十倍系列稀释(从10^-1到10^-12),将15 µL的库噬菌体滴定在TG1对数生长期细胞(步骤D1e)上。在37°C下孵育15分钟后,将10^-4到10^-12稀释度中的50 µL涂布在含100 µg/mL氨苄西林的1%琼脂LB平板上,直至干燥,并在37°C下过夜培养。包括一个仅含TG1的对照组。参见一般注释15。
- 使用这些平板估计可以产生的噬菌体数量。这计算为PFU/mL = 菌落数 × 10(转换为mL)× 0.05(体积)× 稀释倍数。期望值为1 × 10^10–1 × 10^13 PFU/mL。参见一般注释16。
第一轮筛选
注意:在实验室台面上操作。
- 在2毫升微量离心管中,加入500微升StartingBlock缓冲液和500微升分离的库噬菌体(步骤D3j)。用封口膜包好管盖,以防止任何意外溢出,并在室温下使用样品搅拌器孵育30分钟。
- 加入适量的生物素化抗原,以实现1.5毫升中的50纳摩尔终浓度(通过步骤D4d实现)。见通用说明1。用封口膜包好管盖,以防止任何意外溢出,并在室温下使用样品搅拌器孵育1小时。
- 此时,可以开始培养对数期的TG1细胞(步骤D1d-e),这将确保在噬菌体被洗脱(步骤D4h)后,细胞达到所需的OD600。
- 在噬菌体与抗原孵育30分钟后(步骤D4b),在一个新的2毫升微量离心管中,加入100微升streptavidin DynabeadsTM M-280。用500微升PBS洗涤磁珠两次,然后加入500微升StartingBlock缓冲液。在室温下使用样品搅拌器孵育30分钟。
- 将1毫升含抗原的噬菌体(步骤D4b)转移到已阻塞的磁珠(步骤D4d)中。总体积为1.5毫升,最终抗原浓度为50纳摩尔。用封口膜包好管盖,以防止任何意外溢出,并在室温下使用样品搅拌器孵育15分钟。
- 将微量离心管放在DynaMagTM-2磁铁上。一旦磁珠被拉到一侧,丢弃上清中的未结合噬菌体。用500微升PBST重悬磁珠,然后用磁铁使磁珠聚集在管壁一侧,以洗涤松散结合的噬菌体。总共重复此洗涤过程6次,然后用PBS洗涤一次。
- 向磁珠中加入500微升250微克/毫升的胰蛋白酶。用封口膜包好管盖,以防止任何意外溢出,并在室温下使用样品搅拌器孵育30分钟。
- 使用DynaMagTM-2磁铁使磁珠聚集后,收集第一轮淘洗的噬菌体上清,即洗脱出的噬菌体。
注意:在安全柜中工作。 - 在一个50毫升锥形离心管中,加入500微升来自第一轮淘洗的pan1噬菌体上清(步骤D4h)和10毫升的对数期TG1细胞(步骤D4c),在37°C下无摇床孵育30分钟。
- 在2800×g离心10分钟,18°C下沉淀细胞,用1毫升2×YT重悬沉淀。将全部体积铺在含有1%琼脂LB和100微克/毫升氨苄青霉素的生物板上,干燥后37°C过夜孵育。
- 用含25%甘油的6毫升2×YT重悬菌落,分装成1毫升的安瓿瓶,-80°C保存。这是第一轮淘洗的pan1噬菌体子库库存。
扩增和回收子文库
注意:在安全柜中操作。
- 将50 mL 2× YT含有100 µg/mL氨苄青霉素的培养基转移到250 mL的一次性挡板Erlenmeyer烧瓶中,加入足够量的第一轮筛选pan1子库库存(步骤D4k)以使起始OD600约为0.05。见通用注释13。
- 在37°C下,以200 rpm的速度摇动培养基,直到OD600达到0.4-0.6,大约需要2小时。见通用注释14。
- 将10 mL这种培养基转移到50 mL锥形离心管中,加入10 µL的CM13K助剂噬菌体库存(步骤D2h),并通过轻轻搅拌混合。在37°C下孵育1小时,不需振荡。
- 在18°C下,以2,800×g的速度离心10分钟,离心沉淀细胞。用含有100 µg/mL氨苄青霉素和25 µg/mL卡那霉素的2× YT重悬沉淀,并转移到250 mL的一次性挡板Erlenmeyer烧瓶中。在25°C下过夜摇动,以250 rpm的速度摇动。
- 将过夜培养物转移到50 mL锥形离心管中,在4°C下,以3,200×g的速度离心10分钟。
- 将含有噬菌体的40 mL上清液转移到新的50 mL锥形离心管中,加入10 mL冰冷的PEG/NaCl。颠倒几次,并在冰上孵育1小时。
- 在4°C下,以3,200×g的速度离心10分钟,离心沉淀噬菌体。用冰冷的灭菌PBS重悬沉淀的噬菌体,并转移到2 mL离心管中。
- 在4°C下,以20,000×g的速度离心1分钟,将含有噬菌体的上清液转移到新的2 mL离心管中。加入250 µL冰冷的PEG/NaCl,颠倒离心管直到出现均匀的白色悬浮液。在冰上孵育30分钟。
- 在4°C下,以20,000×g的速度离心15分钟,离心沉淀的噬菌体。用冰冷的灭菌PBS重悬沉淀的噬菌体,并转移到2 mL离心管中。
- 在4°C下以20,000×g的速度离心1分钟之后,将含有 pan1 噬菌体的上清液转移到一个新的2 mL离心管中。这是分离出来的第一轮筛选噬菌体;它应保存在冰上或4°C,并可在一个月内保持稳定。
第二轮筛选
注意:在实验台上操作。
- 在一个2毫升的微量离心管中,加入500微升的StartingBlock缓冲液和500微升的分离pan1噬菌体(步骤D5j)。用封口膜包裹微量离心管盖,以防止意外溢出,并在室温下使用样品混合器孵育30分钟。
- 加入适量的生物素化抗原,以达到1.5毫升中的最终5纳摩尔浓度(通过步骤D6d实现)。参见一般注意事项1。用封口膜包裹微量离心管盖,以防止意外溢出,并在室温下使用样品混合器孵育1小时。
- 在此阶段,可以开始培养对数期的TG1细胞(步骤D1d-e),以确保在噬菌体被洗脱(步骤D6h)时,细胞达到所需的OD600。
- 当噬菌体与抗原孵育30分钟(步骤D6b)时,在一个新的2毫升微量离心管中,加入10微升的链霉亲和素DynabeadsTM M-280。用500微升的PBS洗涤磁珠两次,然后加入500微升的StartingBlock缓冲液。在室温下使用样品混合器孵育30分钟。
- 将1毫升的带有抗原的阻断噬菌体(步骤D6b)转移到阻断磁珠(步骤D6d)中。总体积现为1.5毫升,最终抗原浓度为5纳摩尔。用封口膜包裹微量离心管盖,以防止意外溢出,并在室温下使用样品混合器孵育15分钟。
- 将微量离心管放在DynaMagTM-2磁铁上。当磁珠被拉到一边时,丢弃上清液中的未结合噬菌体。通过在500微升的PBST中重新悬浮磁珠,然后使用磁铁将磁珠拉到一边,清洗掉松散结合的噬菌体。总共用PBST清洗六次,然后用PBS清洗一次。
- 向磁珠中加入500微升的250微克/毫升的胰蛋白酶。用封口膜包裹微量离心管盖,以防止意外溢出,并在室温下使用样品混合器孵育30分钟。
- 在使用DynaMagTM-2磁铁沉淀磁珠后,从第二个平底锅中收集上清液中的洗脱噬菌体。注意:在安全柜中操作。
- 为了获得主板的单个菌落(步骤D7),使用对数期TG1细胞(步骤D6c)从10^-1到10^-12进行十倍系列稀释来滴定洗脱的第二轮淘选噬菌体(步骤D6h)。在37°C下孵育15分钟后,将10^-4到10^-12稀释液在含有100微克/毫升氨苄青霉素的1%琼脂LB平板上铺展,直到干燥,并在37°C下过夜孵育。包括一个仅含TG1的对照。参见一般注意事项15和故障排除1。
- 选择大约有100-300个单个菌落的稀释度。
准备主要平板
注意:在安全柜中操作。
- 在一个1 mL的深孔板中,加入含100 µg/mL氨苄青霉素的2× YT 180 µL/孔。从TG1中选择的第2轮筛选噬菌体的滴定板(步骤D6j)上挑选93个单克隆,用93 × 10 µL的尖头移液器,将它们放入每个已填充的孔中。使用多通道移液器移除尖头。留下F12、G12和H12孔,不放入菌落,用作我们的对照组。
- 用细胞培养贴膜盖住板子,并在37°C下以600 rpm的速度过夜摇动。这个过夜培养将用于制备两个储备板,PCR模板板(步骤D7c)和主板(步骤D7d)。首先准备PCR模板板,然后是主板。
- 将过夜培养的20 µL/孔转移到一个有裙边的PCR板中。用PCR箔片盖住板子,并存储在-80°C。这是PCR模板板。
- 在剩余的过夜培养中,加入150 µL/孔的50%甘油,并通过移液器混合。用PCR箔片盖住板子,并存储在-80°C。这是主板。
抗M13噬菌体ELISA实验步骤:
注意:在安全柜中操作。
- 在已装有150微升/孔2×YT的1毫升深孔板中,加入10微升/孔主板(步骤D7d)。用细胞培养粘合密封膜覆盖,并在37°C下以600转/分钟的转速震荡孵化3小时。
准备CM13K辅助噬菌体混合液,将2微升CM13K辅助噬菌体库存液(步骤D2h)加入到10毫升2×YT中。加入30微升/孔准备好的CM13K辅助噬菌体混合液,并在37°C下以600转/分钟的转速震荡孵化1小时。
- 在18°C下以2,800×g离心10分钟,沉淀细胞,并重新悬浮每个孔中的沉淀物于含有100微克/毫升氨苄青霉素和25微克/毫升卡那霉素的400微升2×YT中。
用细胞培养粘合密封膜覆盖盘子,并在25°C下以600转/分钟的转速震荡过夜孵化。
- 在4°C下以4,000×g离心15分钟后,将含有噬菌体的上清液转移到新的0.5毫升深孔板中,并用粘合膜覆盖。在4°C下储存;这可以稳定保存一个月。这是用于抗M13 ELISA(步骤D8l)的培养物。注意:在实验室工作台上操作。
用100微升/孔10微克/毫升中性亲和素TM稀释于PBS中,包被96孔ELISA微孔板,并在4°C下过夜孵化。
- 使用洗板机,用300微升/孔PBST洗涤微孔板五次。
加入100微升/孔50纳摩尔生物素化目标蛋白稀释于PBS中,并在室温下使用微孔板震荡器孵化1小时。参阅常规注释1。
- 使用洗板机,用300微升/孔PBST洗涤微孔板五次。
加入250微升/孔封闭溶液,并在室温下使用微孔板震荡器孵化1小时。
使用洗板机,用300微升/孔PBST洗涤微孔板五次。
加入50微升/孔封闭缓冲液,然后加入50微升/孔抗M13 ELISA培养物(步骤D8e)。在对照孔F12、G12和H12中,加入50微升/孔封闭缓冲液和50微升/孔PBS。在室温下使用微孔板震荡器孵化1小时。
使用洗板机,用300微升/孔PBST洗涤微孔板五次。
加入100微升/孔用0.1% BSA-PBS稀释的抗M13-HRP(最终浓度为0.25微克/毫升),并在室温下使用微孔板震荡器孵化1小时。
使用洗板机,用300微升/孔PBST洗涤微孔板五次。
加入100微升/孔ABTS底物,这是通过将溶液A和溶液B以1:1的比例混合制备的。避光保护,并在405纳米处测量吸光度。参阅常规注释2。
吸光度超过1的孔被认为是阳性结果。参阅故障排除2和3。
PCR及ELISA阳性结果的测序步骤:
在一个5毫升的试管中准备以下PCR反应主混合液,并在一个96孔硬质PCR板中设置96个PCR反应(表12)。参阅常规注释17。用PCR箔密封膜覆盖微孔板。表12. PCR反应组成
Table 12. PCR reaction composition
Reagent Final concentration Volume for single reaction Volume for master mixture Nuclease-free water n/a 18.25 µL 1,825 µL 10 µM PhD seq Fwd primer 0.2 µM 0.5 µL 50 µL 10 µM PhD seq Rev primer 0.2 µM 0.5 µL 50 µL 10× Taq buffer 1× 2.5 µL 250 µL 25 mM dNTP 0.25 mM 0.25 µL 50 µL Taq polymerase 1 unit 0.5 µL 50 µL PCR template (step D7c) 2.5 µL - Total n/a 25 µL 2275 µL 设置热循环仪并执行PCR(表13)
Table 13. PCR cycling conditions
Step Temperature (°C) Duration Number of cycles Denaturation 95 7 min s 1 Annealing 95 15 s 35 Extension 55 30 s Final extension 68 1 min 40 s Hold 68 5 min 1 Denaturation 12 Infinite hold - 向每个孔中加入45微升Highprep PCR磁珠,并用移液器混合。将微孔板放在DynaMagTM 96侧磁铁上1分钟,或者直到溶液清晰,磁珠被拉到PCR管壁上,然后吸掉上清液。
向每个孔中加入100微升70%乙醇,并用移液器混合。将微孔板放在DynaMagTM 96侧磁铁上1分钟,或者直到溶液清晰,磁珠被拉到PCR管壁上,然后吸掉上清液。总共重复这个洗涤步骤三次。
在室温下让磁珠干燥10分钟,然后向磁珠中加入25微升EB缓冲液(来自QIAprep Spin Miniprep试剂盒),并用移液器混合。将微孔板放在DynaMagTM 96侧磁铁上1分钟,或者直到溶液清晰,磁珠被拉到PCR管壁上,然后将含有纯化PCR产物的20微升上清液转移到一个新的96孔带裙边PCR板中。
如果有可同时测量多个样本的纳米光度计(如ImplenTM NanoPhotometer® N120)可用,测量每个孔的A280。如果有单样本纳米光度计可用,测量随机选取的克隆的A280。预期大约为15-25 ng/微升。或者,随机选取的克隆的5微升纯化PCR产物可以与5微升2× DNA凝胶加样缓冲液混合,并在含有1× SYBRTM Safe DNA凝胶染料的1%琼脂糖凝胶上与1× GeneRuler 1 kb DNA分子量标准一起电泳。在1× TBE缓冲液中以80伏特的电压电泳40分钟。对凝胶成像,并确认约500 bp VHH基因的存在。
用PCR箔密封膜覆盖微孔板,并与PhD seq Fwd引物一起送测序。参阅常规注释18。
小规模表达和纯化
通过进行小规模表达,可以确定哪些纳米抗体克隆能够良好地表达和纯化。纯化后添加的脱盐步骤允许使用滴定ELISA或生物层干涉仪(BLI)确认纳米抗体与抗原的结合。通过BLI可以确定纳米抗体的解离速率(kdis)以及初步的表位分型。这些因素有助于选择哪些纳米抗体将用于大规模表达。
小规模表达步骤:
注意:在安全柜中操作.
- 在已装有每孔180微升含有100微克/毫升氨苄青霉素的2× YT的1毫升深孔板中,根据主板(步骤D7d)的测序结果,加入10微升选定的克隆。用细胞培养粘合密封膜覆盖,并在37°C下以600转/分钟的转速震荡过夜孵化。
将每个克隆的过夜培养物的10微升加入到已装有每孔4毫升含有100微克/毫升氨苄青霉素、0.1%葡萄糖和2 mM MgCl2的terrific肉汤的24孔板中。用细胞培养粘合密封膜覆盖,并在37°C下以600转/分钟的转速震荡孵化4小时。
- 向每个孔中加入4微升1 M IPTG(最终浓度为1 mM),用细胞培养粘合密封膜覆盖,并在25°C下以600转/分钟的转速震荡过夜孵化。注意:在实验室工作台上操作。
在4°C下以4,000×g离心15分钟,沉淀细胞,并轻轻重新悬浮沉淀物于300微升1毫克/毫升多粘菌素B硫酸盐中。用粘合膜覆盖盘子,并在室温下使用微孔板震荡器震荡1小时。
- 在4°C下以4,000×g离心10分钟,并将含有周质的上清液转移到新的1.5毫升微型离心管中。
将10微升隔离的周质与10微升2× Laemmli样品缓冲液混合,于95°C下孵化5分钟,并在1× MES缓冲液中与Mark12TM未染色标准一起在NuPage 4%–12%双三预铸凝胶上以200伏特的电压电泳40分钟。
- 使用InstantBlue® Coomassie蛋白染色剂染色。预期在约14 kDa处有明显的条带。参考Expasy Protparam(数据分析,步骤1d)的结果,了解每个克隆的确切大小。
亲和纯化
注意:在实验室台面上工作。
- 使用Ni-NTA离心柱根据制造商的说明进行带有His标签的纳米抗体的亲和纯化。简要地说,向Ni-NTA离心柱中加入600 µL的平衡缓冲液,并在4°C下以2,900 rpm (800× g) 的速度离心2分钟。
- 将周质间隙样本添加到Ni-NTA离心柱中,并在4°C下以1,600 rpm (200× g) 的速度离心5分钟。
- 通过向Ni-NTA离心柱中加入600 µL的平衡缓冲液并离心(2,900 rpm (800× g) ,4°C,2分钟)来洗涤离心柱三次。
- 将Ni-NTA离心柱转移到新的2 mL离心管中,并加入100 µL的洗脱缓冲液。在室温下孵育2分钟后,以2,900 rpm (800× g) 的速度离心2分钟。流穿液中含有纯化的纳米抗体。
- 将5 µL纯化的纳米抗体与5 µL 2× Laemmli样品缓冲液混合,在95°C下孵育5分钟,并在200 V的电压下在1× MES缓冲液中的NuPage 4%–12% bis tris预制凝胶上电泳40分钟,旁边是与Mark12TM未染色标准一起运行。
- 用InstantBlue® Coomassie蛋白染色剂染色。预期在约14 kDa处出现条带。参考Expasy Protparam(数据分析,步骤1d)的结果,了解每个克隆的确切大小。
脱盐
注意:在实验室台面上工作。
- 使用ZebaTM Spin脱盐柱根据制造商的说明对Ni-NTA纯化的纳米抗体进行脱盐。简要地说,折断脱盐柱的底部盖子,松开顶部盖子,并将脱盐柱放入新的2 mL离心管中。在4°C下以1,500× g 的速度离心1分钟。
- 在脱盐柱的侧面做标记,标记处树脂向上倾斜。确保在所有离心步骤中,这个标记都朝外。
- 通过轻轻向树脂床上添加300 µL PBS(或选择的缓冲液)并离心(1,500× g ,4°C,1分钟)来洗涤树脂三次。
- 将脱盐柱转移到新的1.5 mL离心管中,并轻轻将100 µL纯化的纳米抗体(步骤E2d)加入到树脂床的中心。样品完全吸收后,轻轻向树脂床中心添加15 µL PBS(或选择的缓冲液)。在4°C下以1,500× g 的速度离心2分钟,并在流穿液中收集脱盐的纳米抗体。
- 测量脱盐纳米抗体的A280值,并使用从Expasy Protparam获得的个体纳米抗体的kDa和消光系数(ε)来确定摩尔浓度(µM = A280/ ϵ × 106)以及浓度(µg/mL = µM × kDa)。
滴定ELISA
如果没有Octet R8(或类似仪器),可以使用滴定ELISA来确认纯化的纳米抗体与目标蛋白的结合。
注意:在实验室台面上工作。
- 用100 µL/孔的10 µg/mL neutrAvidinTM稀释液(在PBS中)预包被96孔ELISA微板上的适当数量的孔,并在4°C下过夜。
- 用300 µL/孔的PBST洗涤微板五次。
- 加入100 µL/孔的50 nM生物素化目标蛋白稀释液(在PBS中),并在室温下微板振荡器上孵育1小时。参见通用注释1。
- 用300 µL/孔的PBST洗涤微板五次。
- 加入250 µL/孔的封闭液,并在室温下微板振荡器上孵育1小时。
- 用300 µL/孔的PBST洗涤微板五次。
- 将25 µg/mL脱盐纳米抗体(步骤E3d)稀释液(在封闭液中)200 µL/孔加入第一个孔,然后在微板中进行系列稀释,即向第二个孔加入100 µL封闭液,并向第一个孔加入100 µL溶液。总共准备七个稀释度(25–0.39 µg/mL),最后一个孔只加入封闭液。在室温下微板振荡器上孵育1小时。
- 用300 µL/孔的PBST洗涤微板五次。
- 向每个孔中加入100 µL/孔的抗-单峰驼VHH-HRP稀释液(在0.1% BSA-PBS中稀释至1:5,000),并在室温下微板振荡器上孵育1小时。
- 用300 µL/孔的PBST洗涤微板五次。
- 向每个孔中加入100 µL/孔ABTS底物溶液,该溶液通过按1:1的比例混合溶液A和溶液B制备。避光保护,并在405 nm处测量吸光度。参见通用注释2。
解离速率(kdis)的测定使用生物层干涉仪(BLI)
注意:在实验室台面上工作。
在开始实验前至少25°C过夜预热Octet R8,或至少3小时。
通常,纳米抗体和抗原的起始浓度分别为50 nM和100 nM,在Octet稀释缓冲液中制备。参见通用注释19。
在96孔黑聚丙烯板中准备所有稀释液。参见通用注释20。
在这个阶段,每个纳米抗体只需要一个重复。包括无纳米抗体对照,以排除任何与加载抗原的非特异性相互作用,并作为背景。
使用SA生物传感器的实验运行条件如下:
所有孵育步骤的1,000 rpm摇动。
盘定义:在所有基线步骤/孔中使用Octet稀释缓冲液。
实验定义:
在Octet稀释缓冲液中基线600秒。
在抗原稀释的Octet稀释缓冲液中加载300秒。
在Octet稀释缓冲液中基线30秒。
在Octet稀释缓冲液中基线60秒。
在脱盐纳米抗体稀释的Octet稀释缓冲液中结合300秒(注意此步骤,时间可能需要延长,因为我们需要曲线达到平稳)。
在测量基线60秒的柱中解离300秒(此步骤应与结合步骤相同的时间长度)。
纳米抗体亚克隆到细菌和哺乳动物载体
我们开发了两套载体,用于在细菌和哺乳动物表达系统中功能化纳米抗体。它们的设计方式是,任何从按照C节构建的库中鉴定的纳米抗体都可以使用共同的正向引物和标签特定的反向引物以及相同的限制性位点(图8)克隆到它们中。细菌和哺乳动物工具箱中每个载体的特性、功能化标签和引物在表14中详细说明。
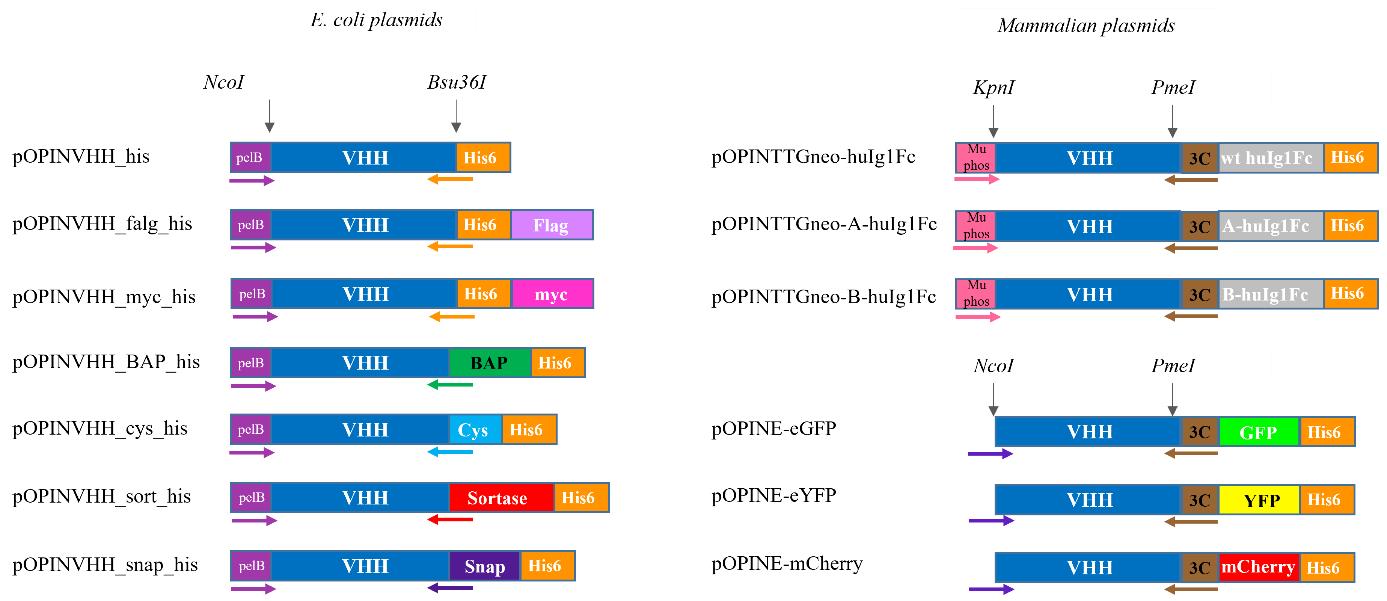
[^图8. 细菌和哺乳动物工具箱中每个载体中引物、限制酶和标签的详细信息。]: 所用缩写:VHH,纳米抗体;BAP,生物素接受肽/Avi-TagTM;wt,野生型;huIg1Fc,人Ig1 Fc。
表14. 细菌和哺乳动物工具箱中载体的特征。 引物中与载体互补的部分以斜体显示。
| Expression system | Vector | Tag | Application | Restriction enzymes | Forward primer (5′–3′) | Reverse primer (5′–3′, reverse complement) |
|---|---|---|---|---|---|---|
| E. coli | pOPINVHH_his | His | Crystallography | NcoI and Bsu36I | GCGGCCCAGCCGGCCATGGCCCAGGTGCAGCTGGTGGAG | GTGATGGTGGCCTGAGGAGACGGTGACCTGGGTC |
| pOPINVHH_flag_his | His and FLAG | Epitope detection | ||||
| pOPINVHH_myc_his | His and myc | Epitope detection | ||||
| pOPINVHH_BAP_his | Avi-tagTM and His | Biotinylation | ATCATTCAAGCCTGAGGAGACGGTGACCTGGGTC | |||
| pOPINVHH_cys_his | Cys and His | Chemical conjugation | ATGGTGACAGCCTGAGGAGACGGTGACCTGGGTC | |||
| pOPINVHH_sort_his | Sortase | Enzymatic labelling | CGGCAGGCCGCCTGAGGAGACGGTGACCTGGGTC | |||
| pOPINVHH_snap_his | SNAP-tag® | Enzymatic labelling | GTCCTTGTCGCCTGAGGAGACGGTGACCTGGGTC | |||
| Mammalian | pOPINTTGneo-huIg1Fc | huIg1Fc and His | Fc fusions | KpnI and PmeI | GCGTAGCTGAAACCGGCCAGGTGCAGCTGGTGGAG | CAGAACTTCCAGTTTAGGGGAGACGGTGACCTGGGTC |
| pOPINTTGneo huIg1FcA (Y407T) | huIg1Fc and His | Bispecific nanobody generation | ||||
| pOPINTTGneo huIg1FcB (T334Y) | huIg1Fc and His | Bispecific nanobody generation | ||||
| pOPINE-eGFP | GFP and His | Fluorescent fusions | NcoI and PmeI | AGGAGATATACCATGCAGGTGCAGCTGGTGGAG | ||
| pOPINE-eYFP | YFP and His | Fluorescent fusions | ||||
| pOPINE-mCherry | mCherry and His | Fluorescent fusions |
根据所需应用,将选定的纳米抗体亚克隆到合适的表达载体中。以下我们详细描述将命中纳米抗体亚克隆到pOPINVHH_His载体中的过程,作为示例。对同一纳米抗体的亚克隆到哺乳动物载体的过程相同。
制备pOPINVHH_His载体的限制性内切酶消化
注意:在实验室台面上工作。
在PCR管中准备以下消化混合物(1 × 100 µL)(表15)。
Table 15. Restriction digestion reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 80.5 µL 10× rCutSmartTM buffer 1× 10 µL NcoI 2.5 units 2.5 µL Bsu36I 2.5 units 2.5 µL 400 ng/µL vector DNA 18 µg 4.5 µL Total n/a 100 µL 短暂地涡旋并离心反应管。
在37°C下孵育1小时,然后在80°C下孵育20分钟。
加入4×体积的B3缓冲液(400 µL)并进行纯化,使用1× Purelink柱从Purelink PCR纯化试剂盒中纯化,根据制造商的说明操作。使用50 µL的E1缓冲液洗脱。测量A280,并期望浓度在60至100 ng/µL之间。
纳米抗体插入片段的制备
注意:在生物安全柜中工作。
从主板(步骤D7d)中,向已填充4 mL/孔的2× YT含100 µg/mL氨苄青霉素的24孔板中加入10 µL选定的纳米抗体克隆,用细胞培养贴膜封盖,并在37°C下过夜摇动,转速为600 rpm。
注意:在工作台上工作。
使用过夜培养的2 mL来使用QIAprep Spin Miniprep试剂盒根据制造商的协议分离质粒。在50 µL的EB中洗脱。测量A280并期待浓度在100至500 ng/µL之间。
连同PhD seq Fwd引物一起发送一个样本进行测序。如果它与通过PCR(步骤D9g)获得的序列匹配,则继续下一步。参见通用注释18。
在PCR管中准备以下反应(1 × 25 µL)(表16)。
Table 16. PCR reaction composition
Reagent Final concentration Volume Nuclease-free water n/a 9 µL 10 µM Common Fwd primer 0.5 µM 1.25 µL 10 µM His FLAG Rev primer 0.5 µM 1.25 µL 2× Phusion flash PCR master mix 1× 12.5 µL 10 ng/µL vector template (step F2b) 10 ng 1 µL Total n/a 25 µL 短暂涡旋并离心反应管。
按照以下设置热循环仪,并执行PCR(表17)。
Table 17. PCR cycling conditions
Step Temperature (°C) Duration Number of cycles Denaturation 98 10 s 1 Annealing 98 1 s 30 Extension 60 1 s Final extension 72 5 s Hold 72 1 min 1 Denaturation 12 Infinite hold - 将5 µL的6× DNA凝胶加载缓冲液加入反应管中,并与1%琼脂糖凝胶中1× GeneRuler 1 kb DNA阶梯的一个井一起在含1× SYBRTM安全DNA凝胶染料的1%琼脂糖凝胶上电泳。在1× TBE缓冲液中以80 V的电压电泳40分钟。
使用LED蓝光透射仪可视化约500 bp扩增的纳米抗体带,用手术刀片从凝胶中切下该带,并使用Nucleospin Gel和PCR纯化试剂盒的一个离心柱根据制造商的协议进行凝胶提取。使用50 µL的NE洗脱,测量A280,并期望浓度在30至100 ng/µL之间。
注意: 在从琼脂糖凝胶中切除带时,使用Safe ImagerTM观察眼镜可视化DNA,并在使用手术刀片时小心谨慎。
连接和转化
注意:在工作台上工作。
在PCR管中准备以下反应(1 × 10 µL)(表18)。
表18. In-Fusion反应组成
Reagent Final concentration Volume Nuclease-free water n/a 5 µL 5× CEII buffer 1× 2 µL 4 ng/µL insert (step F2h) 4 ng 1 µL 19.83 ng/µL vector DNA (step F1d) 19.83 ng 1 µL Exnase II 1 µL Total n/a 10 µL 短暂涡旋并离心反应管。
在热循环仪中于42°C孵育30分钟。加入40 µL的TE缓冲液以终止反应。
注意:在生物安全柜中工作。
在无菌的2 mL离心管中,轻轻混合5 µL的In-Fusion反应和25 µL的StellarTM感受态细胞。在冰上孵育10分钟。
在42°C下进行热激45秒,然后在冰上孵育2分钟。加入200 µL的LB液体培养基,并在37°C下摇动600 rpm孵育1小时。
在含有100 µg/mL氨苄青霉素、2 mM IPTG和40 µg/mL X-gal的1%琼脂LB平板上涂布50 µL的培养基,直至干燥。在37°C下过夜孵育。预期会看到很多白色菌落,很少或没有蓝色菌落。
从转化平板上取两个白色菌落转移到已填充4 mL/孔的2×YT含100 µg/mL氨苄青霉素的24孔板的两个孔中。用细胞培养贴膜封盖,并在37°C下摇动600 rpm过夜孵育。
注意:在工作台上工作。
使用2 mL的过夜培养物,根据制造商的协议使用QIAprep Spin Miniprep试剂盒分离质粒。在50 µL的EB中洗脱。测量A280,并期望浓度在100至500 ng/µL之间。
连同PhD seq Fwd引物一起发送一个样本进行测序。如果它与通过PCR(步骤D9g)获得的序列匹配,则继续下一步。参见通用注释18。
按照Le Bas等人[12]的详细说明使用WK6 E. coli或Expi293TM进行大规模表达,或者使用其他哺乳动物细胞系进行成像实验(参见第G节),具体取决于所选的表达载体。
纳米抗体功能化和应用
通过使用E. coli和哺乳动物工具箱中选择的载体,我们展示了如何将纳米抗体作为用于使用链霉亲和素和pOPINVHH_BAP载体的拉下实验的试剂,以及通过化学偶联使用pOPINVHH_Cys载体和通过转染使用pOPINE-GFP和pOPINE-YFP进行体内和活细胞成像。
确认抗GFP纳米抗体的生物素化
抗GFP纳米抗体被克隆到pOPINVHH_BAP载体中,在大肠杆菌BL21(DE3)-R3-pRARE2-BirA中大规模表达以允许体内生物素化,并通过Ni-NTA和尺寸排阻色谱进行纯化,如第F节和Le Bas等人[12]所述,略有修改。简要来说,LB琼脂平板含有34 µg/mL氯霉素、50 µg/mL链霉素和50 µg/mL卡贝西林,出色培养基补充了50 µg/mL链霉素和50 µg/mL卡贝西林,并在IPTG中添加了0.2 mM生物素。下面,我们详细说明我们如何确认抗GFP纳米抗体已生物素化。
注意:在工作台上工作。
- 将2 µg在pOPINVHH_BAP或pOPINVHH_His中表达的抗GFP纳米抗体和1.5 µL的50 µg/mL链霉亲和素Alexa FluorTM 488偶联物添加到1.5 mL离心管中,用PBS稀释至10 µL。在37°C下孵育30分钟。
- 加入10 µL的2× Laemmli样品缓冲液,在95°C下孵育5分钟,然后在1× MES缓冲液中的NuPage 4%–12% bis tris预制凝胶上电泳40分钟,与Mark12TM未染色标准和BenchMarkTM荧光蛋白标准一起运行,电压为200 V。
- 使用ChemiDocTM成像系统上的ProQ emerald 488图像采集预设对凝胶中的荧光进行成像(蓝色Epi激发,532/28发射滤波器)。用InstantBlue® Coomassie蛋白染色剂染色(图9)。
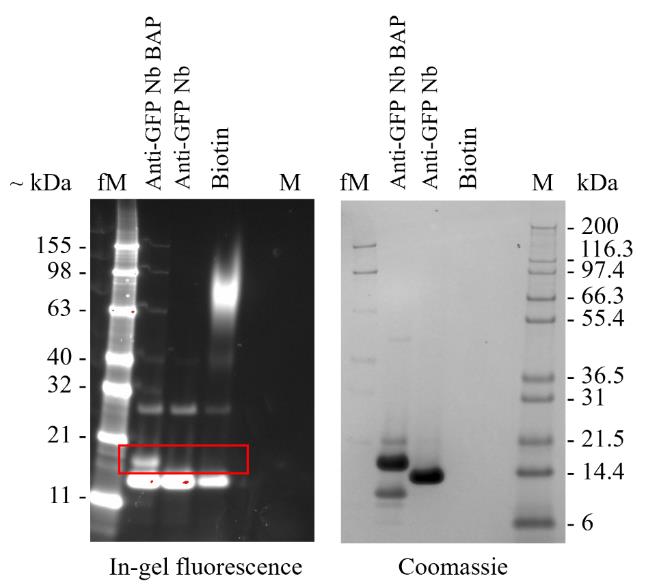
生物素介导的pull down
下面,我们详细说明使用纯化的生物素化抗GFP纳米抗体从掺入的E. coli裂解液中纯化GFP。
注意:在工作台上工作。
- 用1 mL PBS洗涤100 µL streptavidin DynabeadsTM M-280两次。
- 将100 µL 10 µg生物素化抗GFP纳米抗体(稀释在PBS中)加入制备的磁珠中,并在工作台上使用样品混合器孵育30分钟。
- 收集未结合的样品,并用1 mL PBS洗涤磁珠三次。
- 将10 µg纯GFP添加到E. coli裂解液中,用PBS稀释至最终体积100 µL。将此混合物添加到洗涤过的磁珠中,并在工作台上使用样品混合器孵育30分钟。
- 收集未结合的样品,并用1 mL PBS洗涤磁珠三次。
- 将20 µL 2× Laemmli样品缓冲液加入磁珠中。
- 将10 µL每个加载和未结合的样品中加入10 µL 2× Laemmli样品缓冲液。
- 将所有Laemmli处理的样品在95°C下孵育5分钟,并在1× MES缓冲液中的NuPage 4%–12% bis tris预制凝胶上电泳40分钟,旁边是与Mark12TM未染色标准一起运行。
- 用InstantBlue® Coomassie蛋白染色剂染色(图12A)。
荧光素标记
抗波形蛋白(VB3)纳米抗体被克隆到pOPINVHH_Cys载体中,在大肠杆菌WK 6中大规模表达,并通过Ni-NTA和尺寸排阻色谱纯化,如第F节所述。下面,我们详细说明如何制备荧光标记的VB3纳米抗体(VB3-AF647)及其在体内成像中的应用。
注意:在工作台上工作。
将300 µg纯化的VB3纳米抗体与1 mM TCEP pH 8.0混合,补足至100 µL,并在4°C下使用样品混合器孵育20分钟。
将1 µL Alexa FluorTM 647 C2-马来酰亚胺加入VB3纳米抗体溶液中,并在4°C下使用样品混合器孵育1小时。
使用ZebaTM染料和生物素去除离心柱根据制造商的协议从荧光标记的VB3纳米抗体中去除未结合的Alexa FluorTM 647。此样本在4°C下保存两周,避光,但可以快速冷冻并长期保存于-80°C。
将10 µL VB3-AF647与10 µL 2× Laemmli样品缓冲液混合,在95°C下孵育5分钟,并在1× MES缓冲液中的NuPage 4%–12% bis tris预制凝胶上电泳40分钟,旁边是与PageRulerTM预染蛋白梯度一起运行。
使用ChemiDocTM成像系统上的Oriele图像采集预设对凝胶中的荧光进行成像(UV激发,590/110发射滤波器)。用InstantBlue® Coomassie蛋白染色剂染色(图10)。
使用Nanodrop从200到800 nm测量VB3-AF647的吸光度,在750 nm处进行基线校正。预期在280和651 nm处出现峰值,分别对应VB3纳米抗体和Alexa FluorTM 647(图10)。
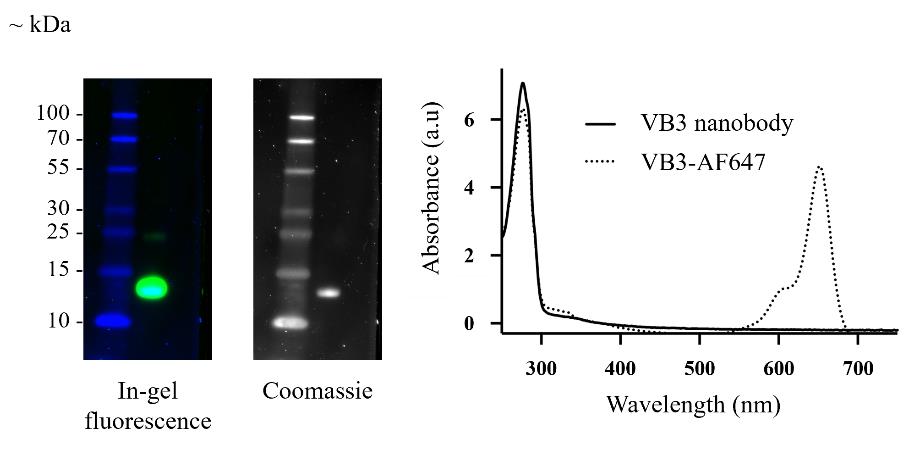
[^]: 图10. 通过凝胶内荧光(左)、InstantBlue®染色(中)和吸收曲线(右)确定在pOPINVHH_Cys中表达的VB3纳米抗体与Alexa FluorTM 647的共轭
体内可视化
注意:在生物安全柜中工作。
将单个盖玻片放入6孔培养板的孔中。在每个孔中播种1 mL的10,000 HeLa细胞,并在无酚红的DMEM培养基中培养,补充10% FBS、1× GlutaMAX™和1×青霉素-链霉素,在37°C和5% CO2的CO2培养箱中。
注意:在工作台上工作。
24小时后,用2 mL PBS洗涤细胞三次,并用2 mL 4% 甲醛固定20分钟。
用2 mL PBS洗涤细胞三次,并在室温下用2 mL共聚焦阻断缓冲液封闭1小时。
在封闭步骤期间,准备荧光标记的VB3纳米抗体溶液,用于标记HeLa细胞中的波形蛋白。在1.5 mL离心管中,向1 mL共聚焦稀释缓冲液PBS中加入5 µL VB3-AF647(步骤G3c),轻轻混合。
移除细胞上的封闭缓冲液,加入制备的VB3-AF647(步骤G4d),并在4°C下使用震荡摇床孵育2小时。
移除VB3-AF647溶液,并用2 mL PBS洗涤细胞三次。
在每个盖玻片上,在显微镜载玻片上滴一小滴含DAPI的Fluoroshield封固剂。使用杜蒙特镊子,小心地从孔中取出盖玻片,使其细胞面向下放置在封固剂上。通过轻轻按压载玻片,去除多余的液体,并在盖玻片周围涂上指甲油以固定。
使用Leica SP8共聚焦显微镜在63×物镜下对准备好的载玻片上的染色细胞进行成像,使用Ex405和Em430–550nm进行DAPI检测,使用Ex633和Em650进行Alexa FluorTM 647检测。
活细胞成像
VB3纳米抗体被克隆到pOPINE-eGFP和-eYFP载体中,如第F节所述。产生的载体被称为pOPINE-VB3-eGFP和pOPINE-VB3-eYFP。下面,我们详细说明如何用pOPINE-VB3-eGFP和pOPINE-VB3-eYFP载体瞬时转染HeLa细胞,以实时成像vimentin丝。
注意:在生物安全柜中工作。
- 在一个8孔盖玻片上,播种200 µL含有25,000 HeLa细胞/孔,并在无酚红的DMEM培养基中培养,补充10% FBS、1× GlutaMAX™和1×青霉素-链霉素,在37°C和5% CO2的CO2培养箱中。
- 24小时后,准备转染混合物如下。在500 µL离心管中,加入10 µL无血清DMEM培养基,轻轻混合2 µL 100 ng/µL的pOPINE-VB3-eGFP和pOPINE-VB3-eYFP载体。加入0.5 µL Fugene转染试剂,并在室温下孵育10分钟。
- 从每个8孔显微镜盖玻片的孔中移除旧培养基,并加入270 µL/孔补充10% FBS的DMEM培养基。将每个DNA-Fugene复合物逐滴加入每个孔中,通过轻轻按下移液管的活塞,在37°C和5% CO2的CO2培养箱中孵育盖玻片48小时。
- 使用Leica SP8共聚焦显微镜在63×物镜下进行活细胞成像,使用Ex405和Em430–550nm进行DAPI检测,使用Ex488和Em518-558进行GFP和YFP检测。
数据分析
序列数据分析(第D9节)
- 将.seq文件拖放到IMGT/V-QUEST网站上。在网站上进行以下选择:物种:Vicugna Pacos(羊驼);受体类型或位点:Ig;选择以Excel格式获取结果。提交。参见通用注释21。
- 生成的Excel文件中有多个标签页。我们将使用第五个标签页(AA-sequences)。按生产性、非生产性和无结果对序列进行排序。
- 然后,按生产性序列的CDR3-IMGT排序以可视化CDR3集群。用不同颜色突出显示不同的CDR3集群有助于选择代表克隆,这些克隆将用于小规模表达。
- 在SnapGene中打开所选克隆的.seq文件以获取氨基酸序列。复制单字母氨基酸序列,粘贴到Expasy - ProtParam工具中。删除pelB序列(MKYLLPTAAAGLLLLAAQPAMA),提交,并记录预期的kDa、pI和消光系数(ε),假设所有Cys残基都已还原。
用于解离速率确定的BLI数据分析(第E5节)
- 在预处理数据标签页中:将无纳米抗体井的背景值减去所有其他测试纳米抗体井的值。将Y轴校正到基线步骤和步骤间到解离步骤。应用Savitzky-Golay过滤。
- 在动力学分析标签页中:分析结合和解离步骤。使用1:1结合模型。使用局部(个体)拟合。拟合完整的结合和解离步骤,并记录计算的解离速率(kdis)。
识别尼帕病毒G蛋白的纳米抗体
纳米抗体生成的改进工作流程通过识别尼帕病毒(Nipah virus)受体结合G蛋白的纳米抗体(NivG)得到了体现。带有N末端六组氨酸标签的NivG蛋白的细胞外区域(183-602号残基)在Expi293TM细胞中表达,并通过结合固定化金属亲和色谱(IMAC)和尺寸排阻色谱进行纯化(图11A)。通过生物素标记的NivG的血清转换ELISA比较了预免疫和后免疫血清,确认了对抗原产生了免疫反应(图11B)。在VHH库进行两轮筛选后,选择了93个噬菌体克隆进行噬菌体ELISA测试。通过PCR扩增噬菌体结合者的序列并进行测序,将翻译的VHH通过CDR3序列身份聚类。从三个主要簇中选择了每个簇的一个代表克隆,在小规模(4 mL培养)下表达,并通过IMAC纯化(图C板)。通过滴定ELISA确认了与NivG的结合(图D板)。通过BLI分析结合解离速率确认了三个克隆(A8、B7和D5)与NivG结合,并优先考虑了大规模表达。
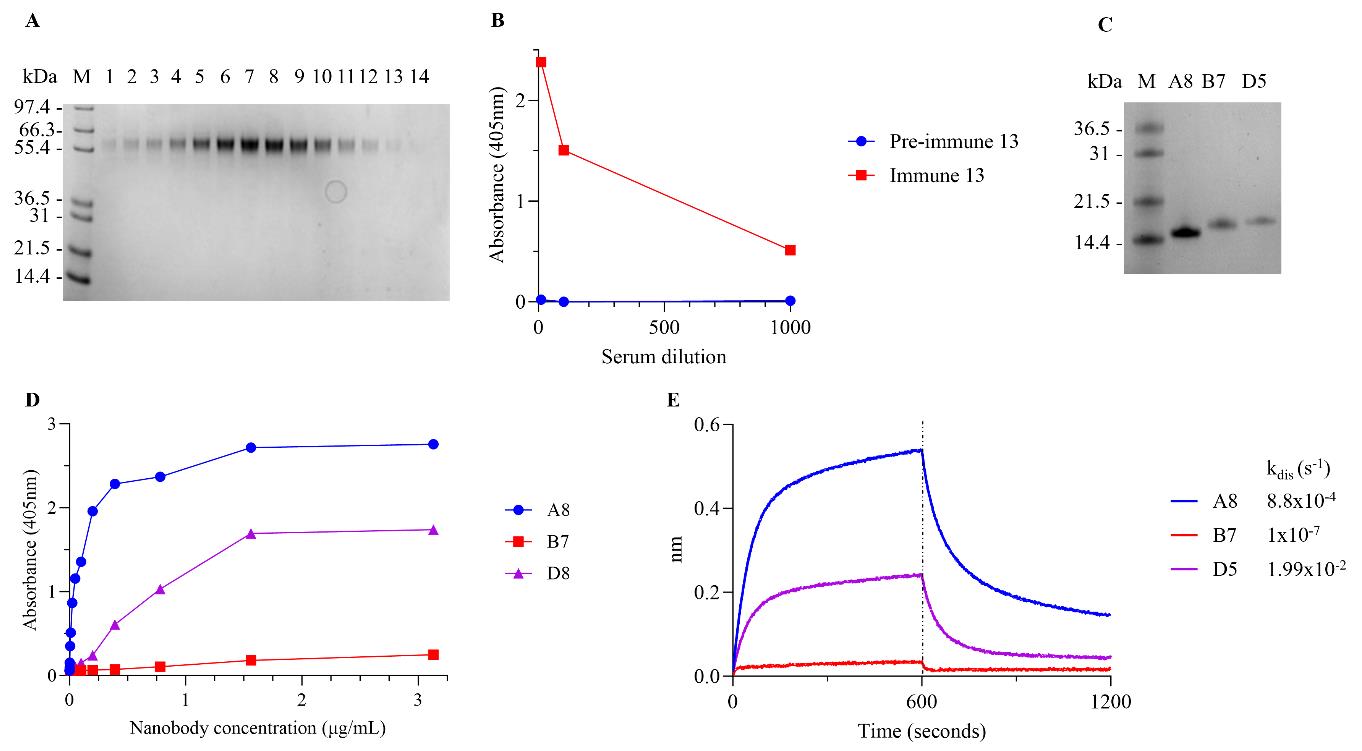
[^图11. 从免疫的羊驼中生成与NivG结合的纳米抗体]: (A) 纯化NivG的凝胶过滤分馏物的SDS-PAGE,(B) 在免疫化羊驼前后,用NivG进行的血清转换ELISA,(C) 小规模表达纯化的抗NiVG纳米抗体的SDS-PAGE,(D) 通过滴定ELISA测定的纯化纳米抗体与NivG 183-602的结合,(E) 纳米抗体与NivG 183-602的结合和解离的BLI轨迹;三个纳米抗体的解离速率显示。
纳米抗体的功能化和应用
使用表1中介绍的三个载体对纳米抗体进行功能化,并将其应用于抗-GFP [9] 和抗-波形蛋白(VB3)[10] 纳米抗体的示例。抗-GFP纳米抗体在pOPINVHH_BAP载体中表达,体内生物素化,并用于从掺入的E. coli裂解液中与链霉亲和素磁珠结合进行GFP的拉下(图12A)。抗-VB3纳米抗体在大肠杆菌中使用pOPINVHH-cys载体表达,纯化,并通过马来酰亚胺连接器与AlexaFluorTM 647耦合。HeLa细胞固定并穿透,用抗-VB3纳米抗体偶联物染色波形蛋白丝(图12B)。相同的纳米抗体通过分别克隆到pOPINE-YFP和pOPINE-GFP载体中与YFP或GFP基因融合。活HeLa细胞转染这些载体,并通过共聚焦显微镜成像来可视化波形蛋白丝(图12C)。
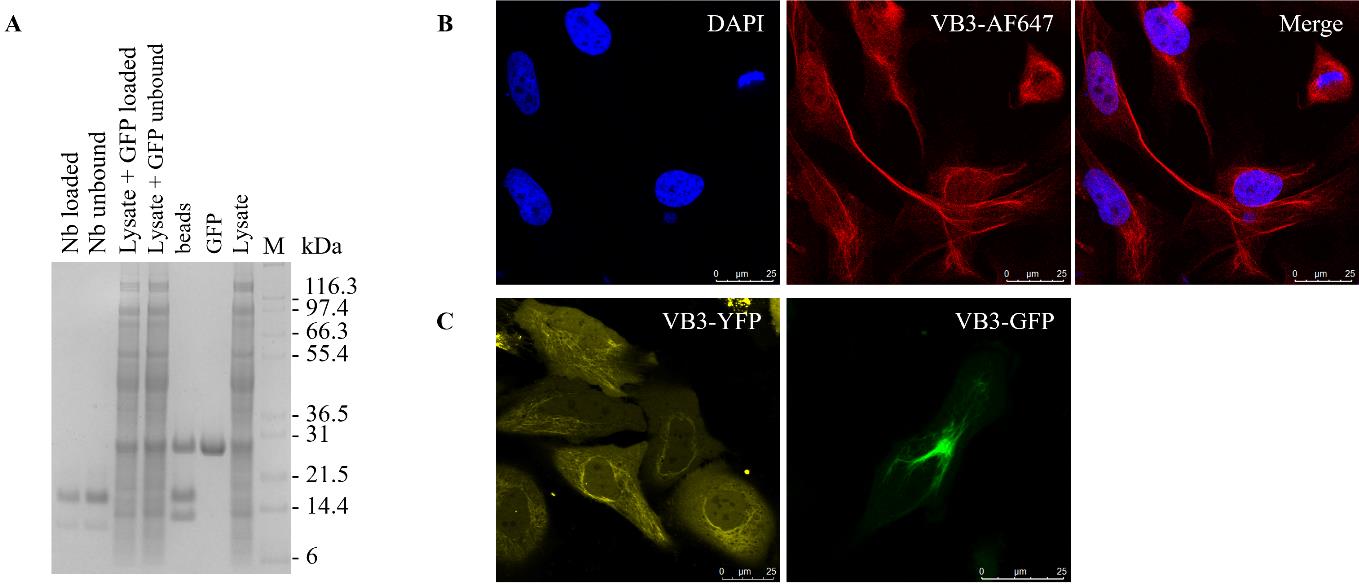
[^图12. 纳米抗体的功能化。]: (A) 通过与链霉亲和素磁珠耦合的生物素化抗-GFP纳米抗体从E. coli裂解液中拉下掺入的GFP。在HeLa细胞中使用(B)荧光标记的抗-波形蛋白纳米抗体(VB3-AF647)检测波形蛋白,以及(C)与VB3-eGFP和VB3-eYFP瞬时转染的成像。
General notes and troubleshooting
General notes
- 制备生物素化蛋白可以通过两种方式实现:化学偶联或通过在带有Avi-tag®序列的蛋白质上进行体外生物素化,并与BirA共表达。
- 预计在底物添加后5-15分钟内会出现颜色发展。如果信号较低,在测量吸光度之前最长的孵育时间为1小时。
- 如果我们收到170 mL无抗凝剂的羊驼血液在17 × 10 mL血液管中,加入等体积的PBS将得到总共340 mL的稀释血液。需要15毫升稀释血液用于每个已加入15毫升Histopaque®-1007的50 mL管中;因此,总共需要22.6个管。因此,第23个管中的稀释血液将少于15 mL。
- 将50 mL锥形离心管以45°角持住,可以让稀释血液轻轻地加在Histopaque®-1007上,以防止Histopaque®-1007层的扰动。在将血液轻轻地层叠在多个50 mL锥形离心管中的Histopaque®-1007上时,下层会变红,因为较重的红细胞沉到管底,这是预料之中的。
- 与PMNCs混合的结晶蓝过猛可能会损伤PMNCs,导致活力值低,这可能不是实际活力的真实反映。
- 如果没有PCR工作站或专门的RNase无污染空间,只需定期更换手套并在处理RNA时使用RNaseZapTM即可。
- 在乙醇中存储的RNA在-20°C下可以稳定存放较长时间。一旦RNA溶解在水中,其稳定性会降低,因此,为了获得最佳结果,我们建议在RNA溶解在水中后尽快进行cDNA合成(步骤C3i)。
- 在电转过程中,预期得到的ms值大于4.5。
- 请注意,小规模库和扩大库的估计库大小会有轻微的差异。
- 计算制作1 × 106 CFU/mL库所需的in-fusion反应微升数的示例:我们用Purelink柱纯化10 µL的in-fusion反应,用20 µL无核酸酶水洗脱。我们用其中的5 µL进行电转,这意味着2.5 µL原始in-fusion反应被加入到30 µL的TG1感受态细胞中。因此,如果2.5 µL的in-fusion库在1:100稀释时产生了373 CFU,那么小规模库的大小将是1.492 × 105 CFU/mL。为了创建一个1 × 106 CFU/mL的库,需要6.7 × 2.5 µL的in-fusion反应,即略多于1 × 10 µL的in-fusion反应。如果已经准备了足够的VHH2和消化过的pADL23c骨架,我们通常会使用比所需更多的in-fusion反应,即10 × 10 µL,以确保我们有最大的机会产生一个1 × 106 CFU/mL的库。
- 如果通过滴度计算的库大小和通过平板密度计算的库大小之间存在很大的差异,请使用平板密度来指导您的决策,以判断库是否足够大。参见图7。
- 在准备起始培养物时,首先使用200 µL的TG1库存。
- 在准备起始培养物时,首先使用20 µL的分离库噬菌体和第1轮筛选子库库存。
- 在某些情况下,培养达到OD600 0.5可能需要超过2小时。继续培养直到达到所需的OD600。只要步骤D3k或D6i中的TG1对照板为阴性,就可以确信这可能只是库和/或子库之间的差异。
- TG1单独控制板用于显示用于此滴度步骤的TG1在滴度步骤之前是否未被噬菌体感染。参见故障排除1和2。
- 步骤C8h–i显示了库的多样性。扩增和回收库的滴定(步骤D3l)给出了我们使用多样库可以制作多少噬菌体粒子的指示。
- 根据实际的ELISA阳性克隆数调整准备好的PCR主混合物的体积。
- DNA和引物的体积和浓度可能因供应商而异。检查当地测序公司的要求。
- 使用足够的抗原来加载生物传感器,以导致1 nm信号增加。
- 必须使用聚丙烯板,因为它们不会结合蛋白质。
- IMGT网站一次只能处理48个序列。如果已测序的克隆超过48个,在按V-DOMAIN功能和CDR3-IMGT排序之前,将两个生成的IMGT Excel文件合并在一起。
故障排除
问题1:在TG1对照板上生长。
可能原因:在向我们的分离/洗脱噬菌体添加之前,E. coli已经受到噬菌体污染。
解决方案:从-80°C中新鲜制备的TG1的稀释液中制备新鲜的TG1对数相。重复滴定有疑问的噬菌体。
问题2:在TG1对照板上生长。
可能原因:氨苄青霉素库存过旧。
解决方案:使用新的氨苄青霉素稀释液,制备新鲜的含氨苄青霉素的1%琼脂LB平板。从“污染”的TG1对照板以及用于生长对数相TG1的甘油库存中取一个菌落,将其涂布在新的平板上。如果没有观察到生长,这表明氨苄青霉素库存过旧,并且TG1在添加我们的噬菌体之前并未受到噬菌体感染。
问题3:在抗M13 ELISA板上只发现一个阳性反应。
可能原因:经过多轮筛选后,结合者数量很少。
解决方案:可以挑选另外93个菌落来制备第二个主板,用于进行抗M13 ELISA测试。
问题4:在用5 nM目标蛋白进行第二轮筛选后,抗M13 ELISA板上没有或只有极少数阳性反应。
可能原因:可能没有富集。
解决方案:回到50 nM噬菌体的筛选,并使用10 nM抗原进行筛选。如果没有发现阳性反应,请尝试故障排除3。如果没有发现阳性反应,考虑查看其他库。使用血清转换ELISA数据来指导这个决定。
References
- Hamers-Casterman, C., Atarhouch, T., Muyldermans, S., Robinson, G., Hammers, C., Songa, E. B., Bendahman, N. and Hammers, R. (1993). Naturally occurring antibodies devoid of light chains. Nature 363(6428): 446–448.
- Bao, G., Tang, M., Zhao, J. and Zhu, X. (2021). Nanobody: a promising toolkit for molecular imaging and disease therapy. EJNMMI Res. 11(1): 6.
- Muyldermans, S. (2020). A guide to: generation and design of nanobodies. FEBS J. 288(7): 2084–2102.
- Parker, J. L., Deme, J. C., Wu, Z., Kuteyi, G., Huo, J., Owens, R. J., Biggin, P. C., Lea, S. M. and Newstead, S. (2021). Cryo-EM structure of PepT2 reveals structural basis for proton-coupled peptide and prodrug transport in mammals. Sci. Adv. 7(35): eabh3355.
- Girt, G. C., Lakshminarayanan, A., Huo, J., Dormon, J., Norman, C., Afrough, B., Harding, A., James, W., Owens, R. J., Naismith, J. H., et al. (2021). The use of nanobodies in a sensitive ELISA test for SARS-CoV-2 Spike 1 protein. R. Soc. Open Sci. 8(9): e211016.
- Huo, J., Mikolajek, H., Le Bas, A., Clark, J. J., Sharma, P., Kipar, A., Dormon, J., Norman, C., Weckener, M., Clare, D. K., et al. (2021). A potent SARS-CoV-2 neutralising nanobody shows therapeutic efficacy in the Syrian golden hamster model of COVID-19. Nat. Commun. 12(1): 5469.
- Akkermans, O., Delloye-Bourgeois, C., Peregrina, C., Carrasquero-Ordaz, M., Kokolaki, M., Berbeira-Santana, M., Chavent, M., Reynaud, F., Raj, R., Agirre, J., et al. (2022). GPC3-Unc5 receptor complex structure and role in cell migration. Cell 185(21): 3931–3949.e26.
- Pardon, E., Laeremans, T., Triest, S., Rasmussen, S. G. F., Wohlkönig, A., Ruf, A., Muyldermans, S., Hol, W. G. J., Kobilka, B. K., Steyaert, J., et al. (2014). A general protocol for the generation of Nanobodies for structural biology. Nat. Protoc. 9(3): 674–693.
- Kirchhofer, A., Helma, J., Schmidthals, K., Frauer, C., Cui, S., Karcher, A., Pellis, M., Muyldermans, S., Casas-Delucchi, C. S., Cardoso, M. C., et al. (2010). Modulation of protein properties in living cells using nanobodies. Nat. Struct. Mol. Biol. 17(1): 133–138.
- Maier, J., Traenkle, B. and Rothbauer, U. (2015). Real-time analysis of epithelial-mesenchymal transition using fluorescent single-domain antibodies. Sci. Rep. 5(1): 13402.
- Tonikian, R., Zhang, Y., Boone, C. and Sidhu, S. S. (2007). Identifying specificity profiles for peptide recognition modules from phage-displayed peptide libraries. Nat. Protoc. 2(6): 1368–1386.
- Le Bas, A., Mikolajek, H., Huo, J., Norman, C., Dormon, J., Naismith, J. and Owens, R. (2022). Production and Crystallization of Nanobodies in Complex with the Receptor Binding Domain of the SARS-CoV-2 Spike Protein. Bio Protoc. 12(9): e4406.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/14/从骆驼到纳米抗体-用于生成功能化 VHH 的简化工作流程/
- 版权声明: 转载请注明出处,谢谢。

