JG Jessica Greaney *,GS Goutham Narayanan Subramanian *, Yunan Ye *,HH Hayden Homer
第一次发布: 2021年08月05日第11卷第15期 DOI: 10.21769/BioProtoc.4104
评审: Chiara Ambrogio 匿名评审
女性出生时拥有一定数量的卵细胞储备,但随着年龄的增长,这些卵细胞的数量和质量都会下降。理解调控卵细胞质量的分子机制对于提高辅助生殖技术中怀孕成功率至关重要。体外培养系统使研究人员能够分析卵细胞成熟和受精的重要分子和遗传调节因子。在此,研究人员详细描述了一种高度可重复的、用于分离和培养成熟小鼠卵细胞的技术。研究人员包括了在体外培养条件下降低有害影响所需的注意事项和预防措施。该技术为多种实验方法奠定了基础,如后转录基因沉默、免疫细胞化学、Western印迹、高分辨率4D时间推移成像和体外受精,这些方法对于剖析卵细胞质量的分子决定因素至关重要。因此,该协议为开始进行探究卵细胞重要分子因素实验的任何卵细胞研究者提供了一个有用、实用的指南。
Background
卵细胞为胚胎提供了大部分细胞质构建块,并且必须经历两次无误的染色体分离,以确保正常的胚胎发育(Chaigne等人,2017;Greaney等人,2017)。这些分离中的第一次,即减数分裂I(MI),尤其容易出错,尤其是随着女性年龄的增长;实际上,卵细胞MI期间出现的错误导致了高达80-90%的人类非整倍体(Greaney等人,2017)。MI也是卵细胞进行对称性破坏的分裂过程,使其能够将一半的染色体排入一个非常小的子细胞(称为极体,PB),同时保留大部分细胞质以支持后续的胚胎发育(Chaigne等人,2017)。众所周知,卵细胞数量、排卵和卵细胞质量是决定生育能力和怀孕成功的三个卵细胞特异性参数(Homer,2020)。尽管有特定的生物标志物和诊断工具来测试卵细胞数量和排卵,但目前还没有确定卵细胞质量的诊断测试。尽管人类卵细胞是研究卵细胞质量的理想材料,但广泛的限制和伦理问题使它们几乎完全无法用于实验。因此,卵细胞质量的分子基础仍然知之甚少,将从深入研究关键方面如减数成熟、受精和胚胎发育等中受益。
通过使用如小鼠这样的哺乳动物模型,研究了调节这些过程的基因的作用。小鼠已成为研究最广泛的模型。
在理解MI染色体分离和不对称分裂的关键分子调节器以及卵细胞对衰老的脆弱性方面的突破性进展,依赖于在体外对卵细胞进行详细分析的能力。该协议的应用范围广泛,包括后转录基因沉默(例如,使用RNAi和morpholinos)、传统的生化分析如Western印迹,以及通过免疫细胞化学和时间推移显微镜对细胞内结构的深入视觉检查。研究人员的实验室在体外培养期间使用了所有这些技术,揭示了卵细胞调节的许多独特方面,如纺锤体组装检查点(SAC)对MI染色体分离的调节及其随衰老的下降(Homer等人,2005;Gui和Homer,2012;Riris等人,2014),独特的卵细胞DNA损伤反应(Subramanian等人,2020)以及对基于DNA损伤的过早卵巢衰老的新遗传见解(Subramanian等人,2021),G2-M边界调控的新方面(Homer等人,2009;Gui和Homer,2013),晚期后着丝点事件对不对称分裂的贡献(Wei等人,2018和2020),以及参与卵细胞衰老和潜在针对这些节点以逆转卵细胞质量差的疗法的关键代谢节点(Bertoldo等人,2020;Iljas和Homer,2020;Iljas等人,2020)。
在研究卵细胞时,存在许多挑战。其中一个主要挑战是卵细胞不能像许多不朽细胞系那样在实验室中繁殖,而必须在每次需要用于实验时作为原代细胞分离。另一个挑战是MI的持续时间非常长,根据小鼠的品系,MI持续6-12小时(相对于几分钟的有丝分裂),需要长时间的实验。另一个挑战是卵细胞的体积很大(约是有体细胞的40倍),这使得识别小的细胞结构变得更加困难。因此,开发一致且可重复的卵细胞分离和培养技术至关重要。
卵细胞培养方法最早在1930年代就已经开发出来(Moricard和de Fonbrune,1937)。后来,实验开发了一种简单的等渗溶液,能够维持卵细胞成熟(Donahue,1968和1970),这使得人们首次能够在MI期间观察卵细胞。随后开发了更复杂的培养介质(Chatot等人,1989),现在,卵细胞分离和培养协议构成了用于研究卵细胞生物学所有体外技术的基石。在这里,研究人员详细描述了一种涉及激素刺激和收集卵巢的方法,然后是卵细胞的分离和体外培养。
在这个协议中,使用孕马血清促性腺激素(PMSG)来刺激腔前卵泡发育,从而增加从卵巢分离的卵细胞产量,并使每只小鼠能够根据品系和年龄获得30-100个卵细胞(Wei等人,2018和2020;Subramanian等人,2020和2021)。通过最小化光照和温度波动的暴露,这个方法减少了由体外培养造成的损伤以及由此产生的伪影。
该协议描述了收集在MI前期的完全成熟卵细胞,其特征是存在一个完整的细胞核,在卵细胞中称为生殖泡(GV)。可以使用化学物质如3-异丁基-1-甲基黄嘌呤(IBMX)来实验性地维持减数分裂I期停滞,IBMX维持高环腺苷酸(cAMP)水平,从而阻止主要M期促进酶——周期蛋白依赖性激酶1(Cdk1)的激活(Zhao等人,2014)。相反,通过洗掉IBMX,可以轻松诱导减数分裂成熟的恢复,从而提供了一种可逆的方法来操纵M期进入。这种方法还允许定时引入小分子抑制剂,在细胞周期中的任何关键时间点干扰调节因子。
该协议的应用广泛,对于推进研究人员对MI调控的理解至关重要。
实验步骤、设备器具和试剂:
实验步骤:
A. 小鼠的激素刺激
- 在生理盐水中制备20 IU/ml的PMSG,并分装成1-ml的体积到1.6-ml微量离心管中。在需要之前储存在-80°C(储存的分装液稳定可达12个月)。
- 在小鼠腹部左下方腹腔注射大约300 µl的PMSG,以达到5-7 IU的最终剂量。
- 将小鼠安置在无菌过滤顶笼中,温度保持在25°C,持续46-48小时,并提供标准饮食和水。
B. 准备口腔吸引器单元
- 点燃含有绝对乙醇的酒精灯。
- 用拇指和食指握住一端的玻璃巴斯德吸管,将细端对准火焰,使其开始软化。
- 从火焰中取出吸管,并迅速将两端拉开,以便拉伸软化的玻璃,目标是达到与卵细胞内部直径相似的大小(大约80 µm)。这可能需要多次尝试才能达到正确的直径,可以通过将拉制的尖端与分离后卵细胞的大小进行比较来确定。
- 将吸管的细端切割或折断到适合操作的长度。
- 要组装口腔吸引器单元,请将巴斯德吸管连接到1000-µl体积的移液管尖端,然后将尖端放入如图1Aii所示的口腔吸引管中。
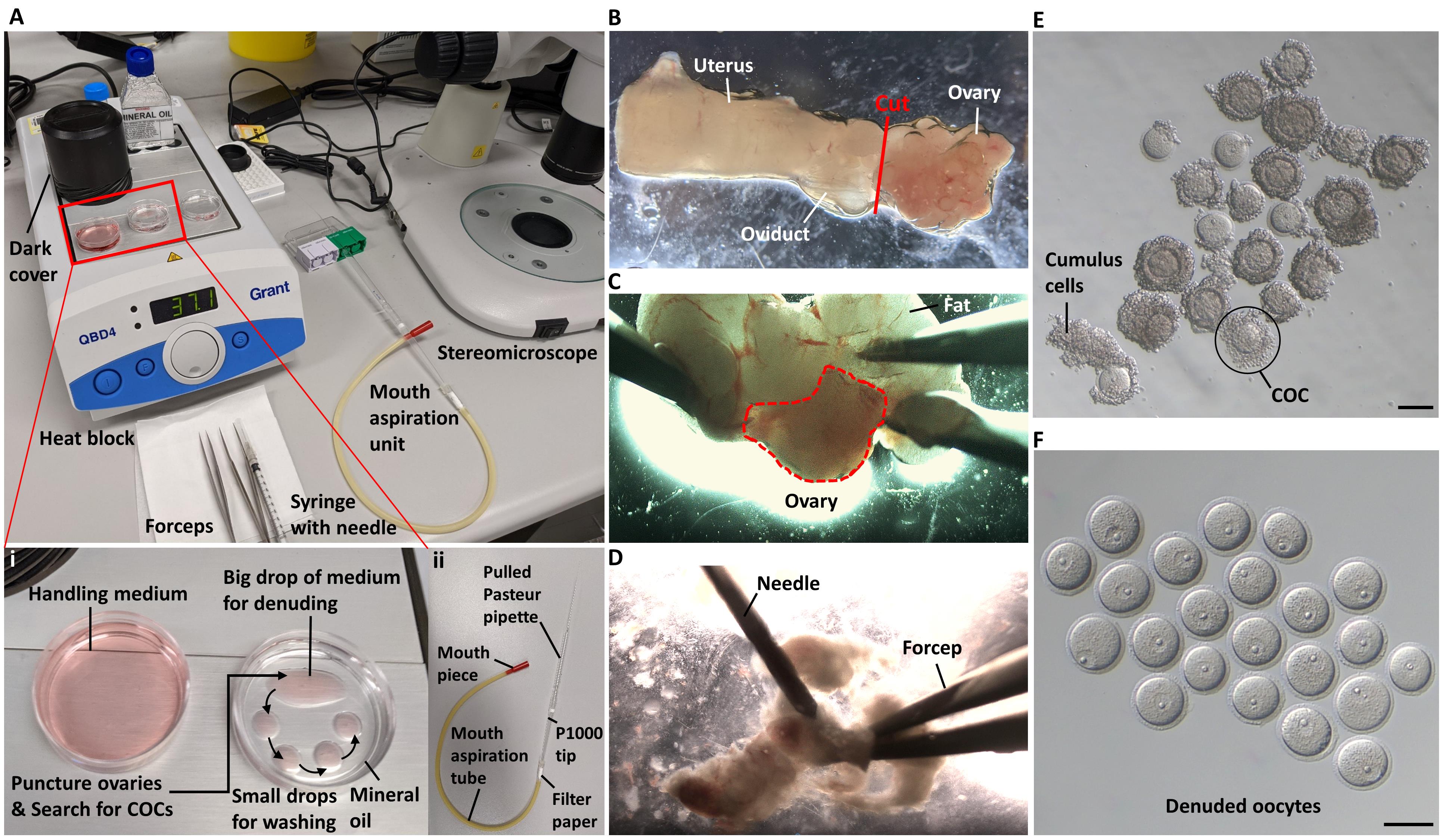
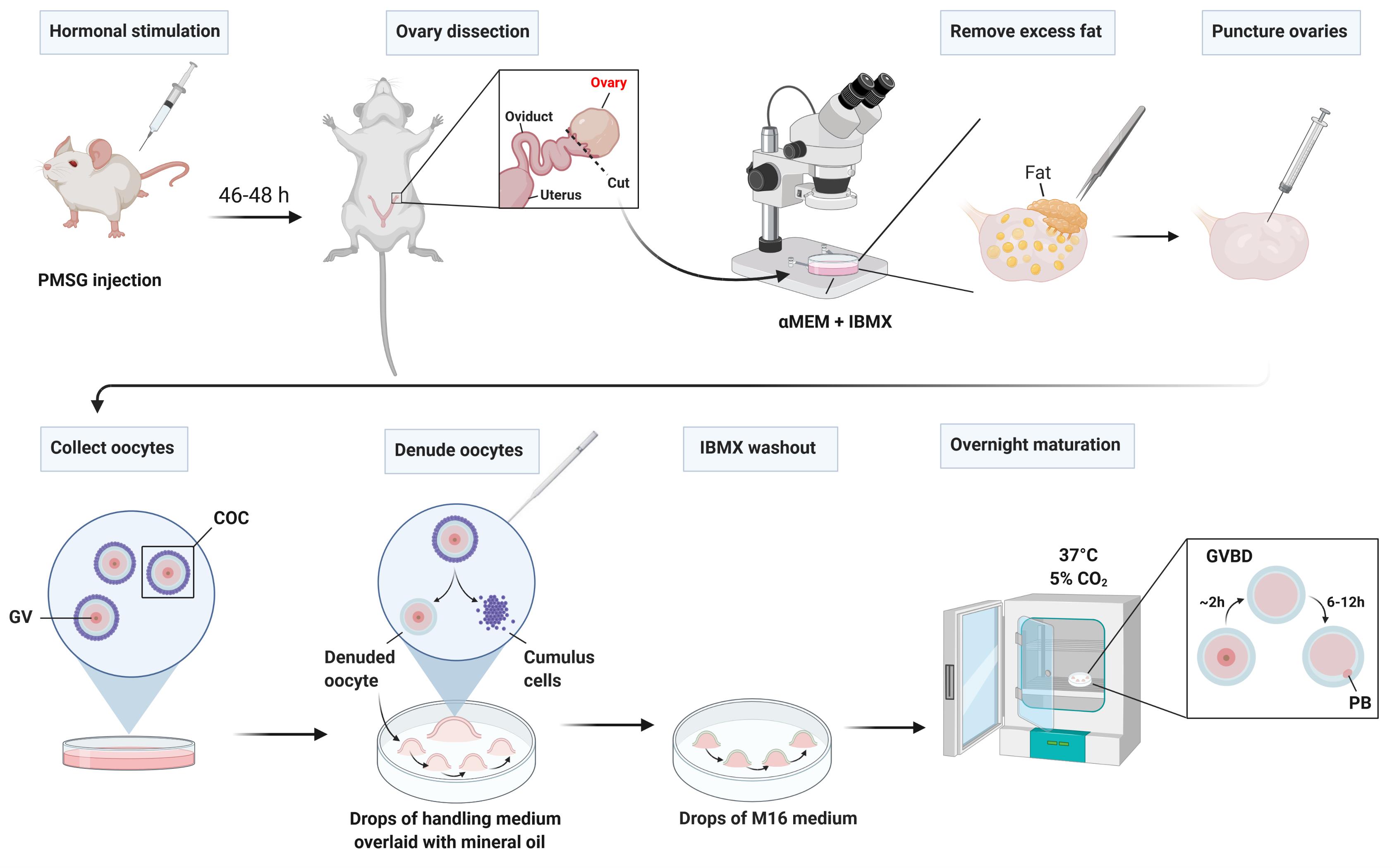
[^图1展示了卵巢收集和卵细胞分离的工作流程。]: (A) 准备解剖工作站。插图展示了用于分离、剥离和连续洗涤卵细胞的盘子(i)和口腔吸引器单元组装(ii)。 (B) 附加输卵管和子宫角的鼠标卵巢的放大明场图像。 (C) 在卵巢和输卵管之间的边界处(切割点)解剖卵巢。展示了一个被脂肪包围的卵巢的放大图像。 (D) 一个去除脂肪的卵巢示例,正在被分解以释放卵丘-卵细胞复合体(COCs)。 (E) 分离的COCs。 (F) 移除卵丘细胞后的剥离卵细胞。标尺:50 μm。
C. 准备处理和培养介质
- 在收集卵巢的前一天,通过0.22-µm的注射器驱动过滤器过滤5 ml M16培养基到15-ml离心管中,并将其放入设置有5% CO2和37°C的培养箱中,松开管盖以允许CO2平衡(见注意1)。
- 在收集卵巢的日子(PMSG注射后46-48小时),在35-mm培养皿中准备3-4个100-µl的CO2平衡M16液滴,并覆盖矿物油以防止蒸发。这个盘子将用于收集后卵细胞的过夜培养。
- 将5 ml处理介质倒入15-ml离心管中,加入0.3% BSA w/v(5 ml介质需要15 mg BSA)。
- 将处理介质放在试管滚筒混合器上,紧闭管盖,让BSA溶解(大约15分钟)。
- 通过0.22-µm的注射器驱动过滤器过滤处理介质,加入IBMX以达到最终浓度为100 µM(见注释2),并在干加热块上预热至37°C。
- 按照图1A所示准备工作站和设备。
- 按照图1A插图所示,在35-mm培养皿中准备覆盖矿物油的IBMX处理处理介质液滴。
- 在1.6-ml微量离心管中准备1 ml IBMX处理处理介质,并在干加热块上预热至37°C。
D. 卵巢收集
- 通过颈椎脱位牺牲小鼠,并将其放置在仰卧位。用70%乙醇喷洒腹部以湿润毛发,防止其进入腹腔。
- 用精细解剖剪在腹部下方做一个小切口,戴上手套,轻轻拉开腹部皮肤以暴露腹膜。
- 用纸巾清洁剪刀上的任何毛发,然后切开腹膜以暴露腹腔。
- 使用精细镊子定位子宫角。轻轻拉动子宫角,沿其头端至末端,找到位于肾脏下极下方的卵巢。
- 使用精细解剖剪沿卵巢附近的子宫角部分进行横切,并从周围组织中解剖卵巢旁脂肪,如图1B和C所示。
- 将卵巢放入在C部分中准备的含有1 ml预温暖的IBMX处理处理介质的试管中,并转移到实验室。
E. 卵细胞分离
- 在实验室中,将卵巢转移到35-mm培养皿中。
- 在立体显微镜下,使用精细镊子和连接到1-ml注射器的27 G针尖,小心去除卵巢周围的输卵管、子宫角和脂肪,确保卵巢不受损伤,如图1C和视频1所示。卵巢呈浅粉色,而脂肪和输卵管呈白色。
- 一旦卵巢去除了脂肪和其他组织,将它们转移到含有2 ml处理介质的另一个35-mm培养皿中。不要在这个介质上覆盖矿物油。
- 用针反复穿刺卵巢以释放卵丘-卵细胞复合体(COCs),如图1D和视频1所示。
- 使用B部分准备拉制的玻璃巴斯德吸管,从培养皿中选择COCs(图1E),并移动到覆盖有IBMX处理过的处理介质液滴的第二个35-mm培养皿中(图1Ai)。
- 使用口腔控制的吸引器单元(口吸管),通过玻璃吸管的尖端反复抽吸和排出COCs,以去除周围的卵丘细胞,产生无卵丘的卵细胞,如图1F和视频1所示(见注意3)。
- 用IBMX处理过的处理介质的连续液滴洗涤剥离的卵细胞,以去除任何残留的卵丘细胞。
F. 卵细胞培养
- 为了诱导减数分裂的恢复,用5-6个100-µl的IBMX-free M16液滴在60-mm培养皿中(不覆盖矿物油)洗涤剥离的卵细胞。
- 将卵细胞放入C部分准备的培养皿中(图2A),并将其放置在37°C和5% CO2的孵化器中进行过夜培养。
- 为了分析生殖泡分解(GVBD)的速率,在从IBMX洗涤后2小时从孵化器中取出卵细胞,并在光学显微镜下通过检查生殖泡(GV)的消失来评分GVBD(如图2B所示)。
- 极体排出(PBE)的速率可以在释放IBMX后大约8-10小时通过在光学显微镜下检查极体的存在来评分,如图2C所示。对于如图2D和E所示的时间序列数据,以30分钟为间隔评分GVBD和PBE(见注释4和5)。
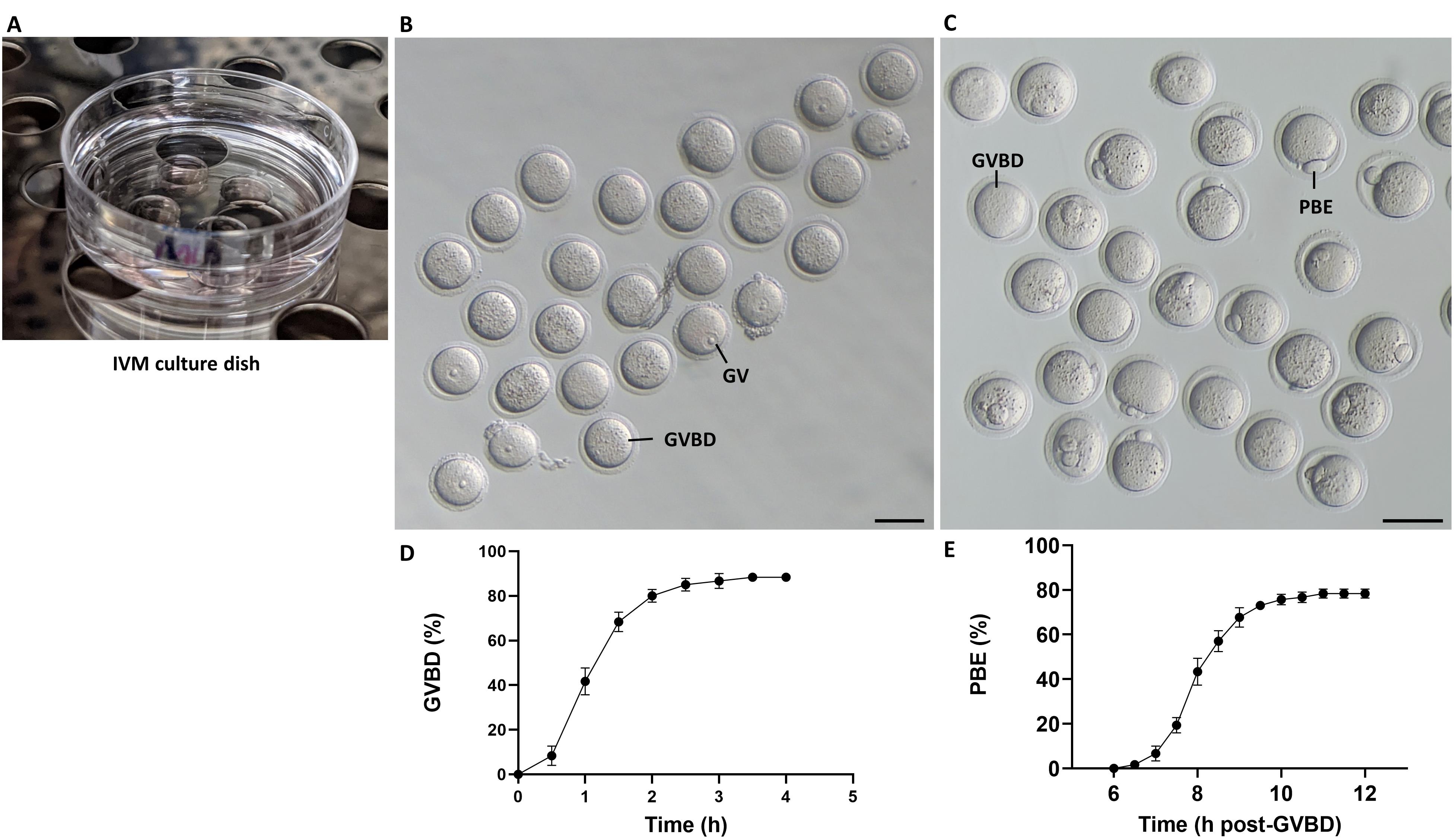
[^图2展示了卵细胞体外成熟(IVM)的工作流程。]: (A) 含有M16培养基液滴和矿物油覆盖层的用于IVM的培养皿在孵化器中的图像。 (B) 在IBMX-free M16培养基中培养的卵细胞的明场图像。注意,在2小时后,大多数卵细胞已经经历了GVBD。 (C) 在IBMX-free M16培养基中过夜培养后,大多数卵细胞已经排出一个小极体。 (D, E) 分别表示从IBMX释放后和GVBD后不同时间点GVBD和PBE的速率。误差条代表三个生物学重复的平均值±标准误。标尺:50 μm。
试剂配方等:
配方
1.卵细胞处理介质
最终浓度:6 mM碳酸氢钠,10 mM HEPES(游离酸),10 mM HEPES(钠盐),100 pg/ml硫酸庆大霉素。见注释7-9。
a. 在称量托盘上称取8.8 g -MEM粉末,并转移到1-L玻璃烧杯中。
b. 向烧杯中加入900 ml MilliQ水,并在磁力搅拌器上搅拌。
c. 向烧杯中加入504 mg碳酸氢钠,2,380 mg HEPES(游离酸)和2,600 mg HEPES(钠盐),搅拌至少15分钟,室温下。
d. 一旦溶质完全溶解,在持续搅拌下检查处理介质的pH值。确保介质的pH值为7.2-7.5。
e. 将介质体积调至1 L,过滤到无菌玻璃瓶中,标记,并在4°C下存储,不超过2个月。
f. 在实验当天,将所需体积的处理介质倒入离心管中,并在开始实验前立即加入0.3% w/v BSA和100 µM IBMX。例如,对于10 ml介质,加入30 mg BSA和5 µl IBMX(储备浓度:200 µM)。
实验室用品清单
- 细胞培养皿;35 × 10 mm 和 60 × 15 mm(Sigma-Aldrich,目录号:CLS430165, CLS 430166)
- 注射器滤器单元;0.22-µm(Merck,目录号:SLGP033RS)
- 微量离心管;0.6-ml 和 1.6-ml(Neptune,目录号:3735.X, 3745.X)
- 离心管;15-ml 和 50-ml(Corning,目录号:352096, 352070)
- 一次性超细针头(27 G × 1/2”;Hanke Sass Wolf,目录号:4710004012)和1-ml注射器(Terumo,目录号:SS+01T 霍乱)
- 玻璃巴斯德吸管(230 mm)(VWR,目录号:6121702)
- 口腔吸引器管组件(Sigma-Aldrich,目录号:A5177)
- 小鼠(>4周龄雌性;使用的品系:B6CBF1)(昆士兰大学生物资源,澳大利亚昆士兰大学)
- PMSG(Prospec,目录号:HOR-272)
- 牛血清白蛋白(BSA;Sigma-Aldrich,目录号:A7096)
- 适合小鼠胚胎培养的轻质矿物油(Sigma-Aldrich,目录号:M5310)
- IBMX(Sigma-Aldrich,目录号:I5879)
- MilliQ水
- 碳酸氢钠(Sigma-Aldrich,目录号:S5761)
- HEPES(游离酸)(Sigma-Aldrich,目录号:H3375)
- HEPES(盐)(Sigma-Aldrich,目录号:H7006)
- 硫酸庆大霉素(Sigma-Aldrich,目录号:G1264)
- M16培养基(Sigma-Aldrich,目录号:M7292)用于体外培养
- α-最小必需培养基(MEM)粉末(Thermo Fisher Scientific,目录号:12000022)(见配方)
设备清单
- 精细解剖剪(Met-App Scientific and Surgical Instruments,目录号:2235)
- 精细镊子(Met-App Scientific and Surgical Instruments,目录号:2127)
- 立体显微镜(Leica Microsystems,型号:M165C; Nikon Microscope Solutions,型号:SMZ800N)
- 干加热块(Grant Instruments,型号:QBD4)
- CO2孵化器(Sanyo,型号:MCO-18AIC)
- 酒精灯(LabTek,型号:LW15557-01)
- 试管滚筒混合器(Ratek,型号:BTR10P-12V)
- 磁力搅拌器(IKA,型号:RCT basic)
数据分析
计算经历GVBD的卵细胞的比例,作为GVBD卵细胞数与总卵细胞数的比率(%)。同样,计算PBE率作为排出极体的卵细胞数与总卵细胞数的比率(%)。
在所需的时间间隔重复评分,总时间长度根据需要而定。例如,可以以0.5小时为间隔,在IBMX释放后总共4小时计算GVBD率,如图2D所示。可以在GVBD后6-12小时内以0.5小时为间隔计算PBE率,如图2E所示(见注释5和6)。
在获得≥3个生物学重复的数据后,使用GraphPad Prism(www.graphpad.com)将平均百分比绘制在折线图上,时间间隔位于x轴,相应的百分比位于y轴。
注意:
- M16培养基在使用前需要进行CO2平衡。由于M16含有酚红pH指示剂,这可以提供是否适当平衡的指示。呈现橙红色的培养基是适当平衡的,但外观为粉红色的培养基没有平衡足够长的时间,不应用于卵细胞培养。
- IBMX在卵细胞分离和处理阶段被添加以抑制GVBD。IBMX也可以添加到M16培养基中,以使卵细胞在GV阶段保持更长时间。
- 尽可能多地用暗盖覆盖处理和培养皿,以减少卵细胞的光照,如图1A所示。
- 频繁从孵化器中取出培养皿可能会使卵细胞暴露于温度波动和过度的光照,这可能会影响成熟速率。
- 卵细胞的产量和GVBD和PBE的时间可能因小鼠品系而异(Parker-Thornburg等人,2011;Polanski,1986和1997;Cheng等人,2012)。研究人员被鼓励首先评估几个品系,以确定最适合他们需求的品系(Luo等人,2011)。
- 在研究人员的实验室中,使用了时间推移显微镜来自动捕获所需间隔的明场图像。如果在IVM后的第二天手动评分PBE,极体可能会降解且难以识别。
- 制作处理介质时,只能使用干净和无菌的烧杯、量筒、称量托盘等。
- 保持培养基的pH值在7.2和7.5之间非常重要。如果pH值不能稳定在这个范围内,应该重新制备培养基。
- 在处理介质中添加HEPES允许在没有CO2孵化器的情况下使用,而不会引起显著的pH波动。
References
- Bertoldo, M. J., Listijono, D. R., Ho, W. J., Riepsamen, A. H., Goss, D. M., Richani, D., Jin, X. L., Mahbub, S., Campbell, J. M., Habibalahi, A., Loh, W. N., Youngson, N. A., Maniam, J., Wong, A. S. A., Selesniemi, K., Bustamante, S., Li, C., Zhao, Y., Marinova, M. B., Kim, L. J., Lau, L., Wu, R. M., Mikolaizak, A. S., Araki, T., Le Couteur, D. G., Turner, N., Morris, M. J., Walters, K. A., Goldys, E., O’Neill, C., Gilchrist, R. B., Sinclair, D. A., Homer, H. A. and Wu, L. E. (2020). NAD+ Repletion Rescues Female Fertility during Reproductive Aging. Cell Rep 30(6): 1670-1681 e1677.
- Chaigne, A., Terret, M. E. and Verlhac, M. H. (2017). Asymmetries and Symmetries in the Mouse Oocyte and Zygote. Results Probl Cell Differ 61: 285-299.
- Chatot, C. L., Ziomek, C. A., Bavister, B. D., Lewis, J. L. and Torres, I. (1989). An improved culture medium supports development of random-bred 1-cell mouse embryos in vitro. J Reprod Fertil 86(2): 679-688.
- Cheng, Y., Zhong, Z. and Latham, K. E. (2012). Strain-specific spontaneous activation during mouse oocyte maturation. Fertil Steril 98(1): 200-206.
- Donahue, R. P. (1968). Maturation of the mouse oocyte in vitro. I. Sequence and timing of nuclear progression. J Exp Zool 169(2): 237-249.
- Donahue, R. P. (1970). Maturation of the mouse oocyte in vitro. II. Anomalies of first polar body formation. Cytogenetics 9(2): 106-115.
- Greaney, J., Wei, Z. and Homer, H. (2018). Regulation of chromosome segregation in oocytes and the cellular basis for female meiotic errors. Hum Reprod Update 24(2): 135-161.
- Gui, L. and Homer, H. (2012). Spindle assembly checkpoint signalling is uncoupled from chromosomal position in mouse oocytes. Development 139(11): 1941-1946.
- Gui, L. and Homer, H. (2013). Hec1-dependent cyclin B2 stabilization regulates the G2-M transition and early prometaphase in mouse oocytes. Dev Cell 25(1): 43-54.
- Homer, H., Gui, L. and Carroll, J. (2009). A spindle assembly checkpoint protein functions in prophase I arrest and prometaphase progression. Science 326(5955): 991-994.
- Homer, H. A. (2020). The Role of Oocyte Quality in Explaining “Unexplained” Infertility. Semin Reprod Med 38(1): 21-28.
- Homer, H. A., McDougall, A., Levasseur, M., Yallop, K., Murdoch, A. P. and Herbert, M. (2005). Mad2 prevents aneuploidy and premature proteolysis of cyclin B and securin during meiosis I in mouse oocytes. Genes Dev 19(2): 202-207.
- Iljas, J. D. and Homer, H. A. (2020). Sirt3 is dispensable for oocyte quality and female fertility in lean and obese mice.FASEB J 34(5): 6641-6653.
- Iljas, J. D., Wei, Z. and Homer, H. A. (2020). Sirt1 sustains female fertility by slowing age-related decline in oocyte quality required for post-fertilization embryo development. Aging Cell 19(9): e13204.
- Luo, C., Zuniga, J., Edison, E., Palla, S., Dong, W. and Parker-Thornburg, J. (2011). Superovulation strategies for 6 commonly used mouse strains. J Am Assoc Lab Anim Sci 50(4): 471-478.
- Moricard, R. and de Fonbrune, P. D. (1937). Nouvelles études expérimentales sur les mécanismes de la formation du premier globule polaire in vitro chez les mammifères. Arch Anat Microscop 33: 113-138.
- Polanski, Z. (1986). In-vivo and in-vitro maturation rate of oocytes from two strains of mice. J Reprod Fertil 78(1): 103-109.
- Polanski, Z. (1997). Genetic background of the differences in timing of meiotic maturation in mouse oocytes: a study using recombinant inbred strains. J Reprod Fertil 109(1): 109-114.
- Riris, S., Webster, P. and Homer, H. (2014). Digital multiplexed mRNA analysis of functionally important genes in single human oocytes and correlation of changes in transcript levels with oocyte protein expression. Fertil Steril 101(3): 857-864.
- Subramanian, G. N., Greaney, J., Wei, Z., Becherel, O., Lavin, M. and Homer, H. A. (2020). Oocytes mount a noncanonical DNA damage response involving APC-Cdh1-mediated proteolysis. J Cell Biol 219(4): e201907213.
- Subramanian, G. N., Lavin, M. and Homer, H. A. (2021). Premature ovarian ageing following heterozygous loss of Senataxin. Mol Hum Reprod 27(2).
- Wei, Z., Greaney, J., Loh, W. N. and Homer, H. A. (2020). Nampt-mediated spindle sizing secures a post-anaphase increase in spindle speed required for extreme asymmetry. Nat Commun 11(1): 3393.
- Wei, Z., Greaney, J., Zhou, C. and H, A. H. (2018). Cdk1 inactivation induces post-anaphase-onset spindle migration and membrane protrusion required for extreme asymmetry in mouse oocytes. Nat Commun 9(1): 4029.
- Zhao, X., Yu, D., Feng, C., Deng, X., Wu, D., Jin, M., Wang, E., Wang, X. and Yu, B. (2014). Role of Greatwall kinase in release of mouse oocytes from diplotene arrest. Dev Growth Differ 56(9): 669-678.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/11/小鼠卵母细胞的分离与体外培养/
- 版权声明: 转载请注明出处,谢谢。

