Int J Biol Sci 2024; 20(3):1024-1041. doi:10.7150/ijbs.89480
Aviya Stopel, Cheli Lev, Stav Dahari, Or Adibi, Leah Armon, Nitzan Gonen 
My Notes:
根据全文的研究内容,我们能得出以下结论:
- 研究者成功从小鼠的新生儿和胚胎的睾丸细胞中培养出了类器官,这些类器官能维持结构和基因表达谱9周。
- 胚胎时期睾丸细胞比新生儿更容易形成类器官,显示类器官的生成与Sertoli细胞的成熟程度有关。
- 通过调节培养基的生长因子和激素,研究者可以促进新生神经器官Sertoli细胞向成熟状态的转变。
- 类器官支持精原干细胞进入减数分裂,表明它具有支持精原发生和精子生成的潜能。
- 类器官类似于体内睾丸的结构,包含支持细胞、Leydig细胞等所有主要的细胞类型。
文章的研究给我们以下启示:
- 类器官为研究睾丸发育和功能障碍提供了一个三维的体外模型。
- 可用于研究不同细胞类型之间的相互作用,以及建立遗传疾病模型。
- 通过使用不同的培养基,可以在体外模拟睾丸不同发育阶段。
- 该类器官支持精原干细胞进入减数分裂,可能具有生产精子的潜力,应用于临床不孕不育治疗。
简化的操作步骤是:
- 睾丸细胞的收集:
- 收集P4-7日龄幼崽或成年小鼠的睾丸。
- 将睾丸切成小块,在37°C、0.045%胰蛋白酶和0.25%胶原酶II溶液中消化30分钟。
- 经过消化后,加入含青霉素-链霉素的DMEM/F12培养基,通过70微米细胞筛过滤。
- 离心沉淀细胞,用培养基重新悬浮,并计数细胞数量。
- 从E12.5-14.5小鼠胚胎中收集睾丸,分离出中肾后,对睾丸进行酶消化,过滤,离心,悬浮并计数,以进行后续培养。
- 2D培养睾丸细胞:
- 在6孔板中分别用0.2%明胶或不同浓度Geltrex涂层。
- 使用含血清的培养基培养时,取约0.6x10^6个细胞/孔。
- 使用定义培养基培养时,取约1.2x10^6个细胞/孔。
- 在34°C、5% CO2条件下,替换每3-4天的培养液。
- 类器官的生成和培养:
- 在每个Transwell膜上接种2-2.5x10^5 (胚胎)或3.5x10^5 (新生)细胞用作建立类器官。
- 在34°C下用5% CO2进行培养,使用定义的培养基更换每3-4天的培养液。
- 尽管对于过渡实验,需在未成熟培养基中培养10天,然后转为成熟培养基再培养11天,总计为21天。
Abstract
我们利用transwell插入物从新生小鼠的原代睾丸细胞中成功培育出了睾丸类器官。这些类器官能够形成类似体内睾丸的管状结构和细胞组织,其基因表达谱也与体内睾丸相似。值得注意的是,只有胚胎睾丸细胞能够形成这些类器官,而成人睾丸细胞则不能。这些类器官在培养中可以维持8-9周,并显示出进入减数分裂的迹象。此外,我们还开发了一种特定的培养基配方,可以促进支持细胞和间质细胞的成熟状态,从而实现类器官在体外的成熟。这些睾丸类器官为研究睾丸发育和功能提供了一个有前景的模型系统,对于理解和治疗性别发育障碍及不育症具有重要的转化应用价值。
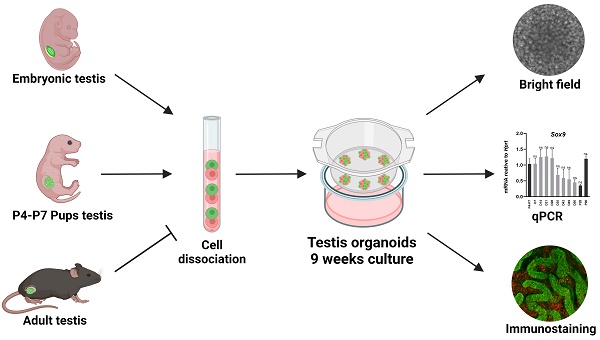
Introduction
睾丸是男性生殖系统的一部分,负责精子生产和雄激素的终身产生和分泌[1, 2]。在小鼠中,睾丸在胚胎第11.5天从双向潜能性腺发育而来,这时性别决定基因Sry及其下游目标基因Sox9被表达[3, 4]。睾丸由睾丸索和间质两部分组成。睾丸索由包裹生殖细胞(生殖细胞)的支持细胞构成,而周管肌样细胞(PM)位于睾丸索外部,与支持细胞一起帮助形成主要由细胞外基质(ECM)蛋白构成的睾丸基底膜。间质中则包含分泌雄激素的间质细胞,以及内皮细胞、免疫细胞和前体细胞[1, 5]。在青春期,支持细胞从幼稚状态转变为成熟状态,睾丸索也随之发育为生精小管。在这个阶段,原先位于睾丸索中心的生殖细胞迁移至小管外围,紧邻基底膜,此时被称为精原干细胞(SSC)。成年期,位于特定生态位中的SSC是精子发生的一生之源[6]。支持细胞是唯一与生殖细胞直接接触的体细胞,它们在培育和支持生殖细胞增殖、成熟及精子发生方面发挥着至关重要的作用[1-3]。支持细胞被认为是睾丸在胚胎和成年阶段的关键“组织中心”[1-3]。
睾丸的发育或功能异常可能导致包括性别发育障碍(DSD)和不育症在内的多种疾病。DSD指的是个体在遗传、生殖腺和解剖性别之间存在不一致,其新生儿发病率大约为1:4000[7, 8]。虽然已有研究表明许多基因和通路与DSD有关,但目前只有50%的DSD病例在全面外显子测序(WES)后得到了遗传诊断,这提示我们需要进一步研究,以更深入地了解哺乳动物的性别决定机制和DSD的病理。不育症定义为在12个月或更长时间的规律无保护性行为后未能实现怀孕,大约每6人中就有1人面临这种情况[9],其中男性不育症约占50%的病例。尽管男性不育症容易被识别和分为不同亚组,但目前对于导致男性不育的遗传和环境机制的了解仍然有限[10]。
到目前为止,还没有适当的体外系统来模拟胚胎或成体阶段的睾丸。在二维环境和含血清的培养基中培养原代睾丸细胞会导致它们失去正常特征,其基因表达模式迅速与正常睾丸不同[11]。此外,目前还没有可靠的睾丸细胞系能够真实地模拟体内睾丸细胞[12]。这些限制使得对睾丸发育的研究只能依赖于小鼠体内的模型,这个过程既耗时又昂贵,且劳动强度大。另外,尽管小鼠和人类的性别决定和睾丸功能系统通常相似,但它们并不完全相同,许多性别发育障碍(DSD)和男性不育症病例无法在小鼠中成功建模[13, 14]。因此,从小鼠和人类中生成睾丸类器官,无论是基于原代细胞还是干细胞的方法,都可以作为一个有用且强大的平台,用于探索正常睾丸发育及相关病理。
类器官是在体外培养的三维结构,它们在结构和功能上与真实器官非常接近[15]。目前已有多种类型的类器官被开发出来,包括肠道、大脑、肾脏、视网膜等[15]。最近几年,一些研究描述了睾丸类器官的生成,这些类器官主要来自人类、小鼠、猪和鼠的原代睾丸细胞(相关综述见[16, 17])。这些研究采用了多种不同的方法来培养原代睾丸细胞,包括脱细胞睾丸、Matrigel、软琼脂以及微流控设备[18-23]。尽管有些模型能够重现睾丸结构和类似管状结构的形成,保持生殖细胞,甚至轻微进入减数分裂,但大多数模型未能显示出长期保持类器官的能力,并且没有与体内睾丸进行基因表达谱的比较。
在这项研究中,我们使用了两种转基因小鼠株,使我们能够追踪支持细胞的存在和状态,并探索了各种培养和培养基条件,以从原代睾丸细胞生成睾丸类器官。我们证明了提供气液界面的transwell插入物是生成睾丸类器官的最佳选择。这些由新生幼崽的原代睾丸细胞形成的类器官可以在体外培养9周,同时保持与相应阶段的体内睾丸在结构和基因表达谱上密切相似。这些类器官保持了所有主要体细胞类型和生殖细胞的存在,并组织成类似管状结构和间质区域。我们进一步展示了这些设置也可以用于培养具有管状结构的胚胎睾丸来源的类器官。我们开发了定义明确的培养基配方,可以促进支持细胞和间质细胞的幼稚或成熟状态,因此可能为类器官的体外成熟提供一个平台。最后,我们展示了这些类器官能够支持精原干细胞进入减数分裂的第一个迹象。
材料与主要方法
所有动物都根据巴伊兰大学伦理协议57-08-2019和61-11-2020的要求进行了适当的饲养。小鼠TESCO-CFP[24]和Sox9-IRES-GFP[25]被维持在F1(C57BL/6J X CBA)遗传背景下。用于基因分型的引物列在表S2中。本研究中使用的胚胎和动物要么是TESCO-CFP纯合子,要么是Sox9-IRES-GFP杂合子以表达绿色荧光蛋白(GFP)。
睾丸细胞的收集
P4-7日龄幼崽或成年小鼠的睾丸被解剖取出,首先通过用镊子将其切成小块进行机械性分离。接下来,为了获得单细胞睾丸细胞悬液,将睾丸小块在含有0.045%胰蛋白酶(Thermo Scientific, 25300062)和0.25%胶原酶II(Worthington, LS004176)最终浓度的37°C温育30分钟,期间每隔10分钟轻轻摇动。然后,向悬液中加入8mL含有1x青霉素-链霉素溶液(Thermo Scientific, 15140122)和2mM L-谷氨酰胺(Biological Industries, BI-03-020-1A)的DMEM/F12(Thermo Scientific 12634-010)培养基,并通过70微米细胞筛(Lifegene, CSS010070S)过滤。在4°C下以300 x g离心5分钟,细胞沉淀用10mL培养基重新悬浮,并用Countess II(Invitrogen)计数细胞数量。
对于胚胎类器官,在E12.5-14.5日龄收集胚胎,将中肾定为E0.5。睾丸被取出,与中肾分开,并在上述条件下用酶消化8分钟。然后加入3毫升含有1x青霉素-链霉素和2mM L-谷氨酰胺的DMEM/F12培养基,细胞离心,细胞沉淀用1毫升培养基重新悬浮,并计数细胞数量。
2D培养睾丸细胞
在培养前,6孔板(Corning 3516)要么用0.2%明胶(Sigma-Aldrich G9391)涂层,并室温下放置至少15分钟,要么用Geltrex(Thermo Scientific A1413201)在冷DMEM/F12培养基中稀释,稀释比例分别为1:100、1:50、1:20,37°C下放置60分钟,然后室温下放置30分钟。在使用含血清的培养基时,每个6孔板放置一个半睾丸的细胞(约0.6x10^6个细胞)。在使用处理好的培养基时,每个6孔板播种一个睾丸的细胞(约1.2x10^6个细胞)。由于在血清基质培养基和处理好的培养基下细胞的扩增速率不同,所以在两种条件下播种的细胞量不同。细胞在34°C、5% CO2培养箱中培养,最多7天。每3-4天更换一次培养基。培养基配方见表S1。
类器官的生成和培养
将睾丸细胞接种在Transwell 0.4μm孔聚酯膜(Corning 3450 / Greiner 657641)上,胚胎类器官每个类器官2-2.5x10^5 个细胞,新生儿和成人类器官每个类器官3.5x10^5 个细胞。将 7-9 个类器官作为颗粒接种在一个跨孔插入物上,类器官之间有间隙。在 34°C 下在 5% CO 2 培养箱中用指定的培养基(培养基组成见表 S1)培养类器官。每 3-4 天从 transwell 插入物下方更换培养基。对于过渡实验,将类器官在未成熟培养基(表S1)中培养10天,然后将培养基更换为成熟2培养基(表S1)再培养11天,总共持续时间为21天。
RNA分离、cDNA制备和qRT-PCR
根据制造商的实验方案,使用 TRIzol™ 试剂 (Thermo Scientific, 15596026) 从小鼠睾丸或类器官中提取总 RNA。通常,RNA 样品使用 3-4 个类器官。使用 NanoDrop 分光光度计定量 RNA 产量,并用 RQ1 DNase (Promega M610A) 处理 1500 ng RNA,并使用 SuperScript™ III 逆转录酶 (Thermo Scientific 18080085) 合成 cDNA。使用 Power SYBR Green PCR 预混液 (Thermo Scientific 4367659) 和正向和反向引物各 140 nM 进行 qRT-PCR 反应,并在 QuantStudio 1 实时荧光定量 PCR 系统 (Thermo Scientific) 上进行分析。所用引物列于表S3中。
类器官成像和类器官大小的测量
所有类器官的明场和荧光图像均使用尼康Eclipse Ts2R显微镜拍摄。对于类器官尺寸评估,在尼康Eclipse Ts2R显微镜上拍摄明场图像,并使用NIS-Elements D软件测量类器官面积(N=3-14个类器官)。
冰冻切片和全片免疫染色
睾丸被取出并在4°C下用4%的多聚甲醛固定过夜,同时旋转。然后,睾丸用含有0.1% Triton X-100的PBS(PBST)清洗三次,并在4°C下用20%的蔗糖孵育,直到嵌入OCT。嵌入的样本用冷冻切片机制成10微米厚的矢状切片。在65°C下使用DAKO的抗原恢复溶液进行抗原恢复30分钟。然后,样品在含有10%驴血清的PBST中封闭1小时,并在4°C下与一抗(稀释在含有1%驴血清的PBST中)孵育过夜。PBST中洗涤三次后,加入二抗和4’,6-二氨基-2-苯基吲哚(DAPI)室温下孵育1小时。最后,将载玻片洗涤、干燥并固定。
对于整体免疫染色,类器官在室温下用4%的多聚甲醛固定20分钟。然后在含有5%驴血清的PBS + 0.3% Triton X-100溶液中进行封闭,室温下持续2-3小时。一抗在PBS + 0.3% Triton X-100溶液中补充10%驴血清,并在4°C下过夜孵化。PBS + 0.3% Triton X-100中洗涤六次后,类器官与二抗和DAPI在4°C下过夜孵化。接着,它们在PBS + 0.3% Triton X-100中洗涤,并转移到含有固定液的玻璃载玻片上。所有一抗和二抗的使用均列在表S4中。使用Leica Microsystems SP8共聚焦显微镜获得图像。
部分主要结果
使用基于血清或确定的培养基对原代睾丸细胞进行 2D 培养
我们的目标是寻找生成睾丸类器官的最佳培养条件和培养基。由于已知支持细胞在睾丸中负责协调性腺的特化和组织[1],我们使用了两种带有特异性标记支持细胞荧光蛋白的报告小鼠株。这使得我们能够追踪支持细胞的状态,并监测类器官中Sox9的表达水平,Sox9是支持细胞的一个关键标志。第一种小鼠株是TESCO-CFP株,其中Sox9睾丸特异性增强子TESCO位于CFP报告基因的上游[24]。第二种小鼠株是Sox9-IRES-GFP株,其中IRES-GFP位于Sox9编码序列的下游[25]。两种报告小鼠株都在胚胎和成年性腺的支持细胞中表达CFP或GFP(补充图1)。
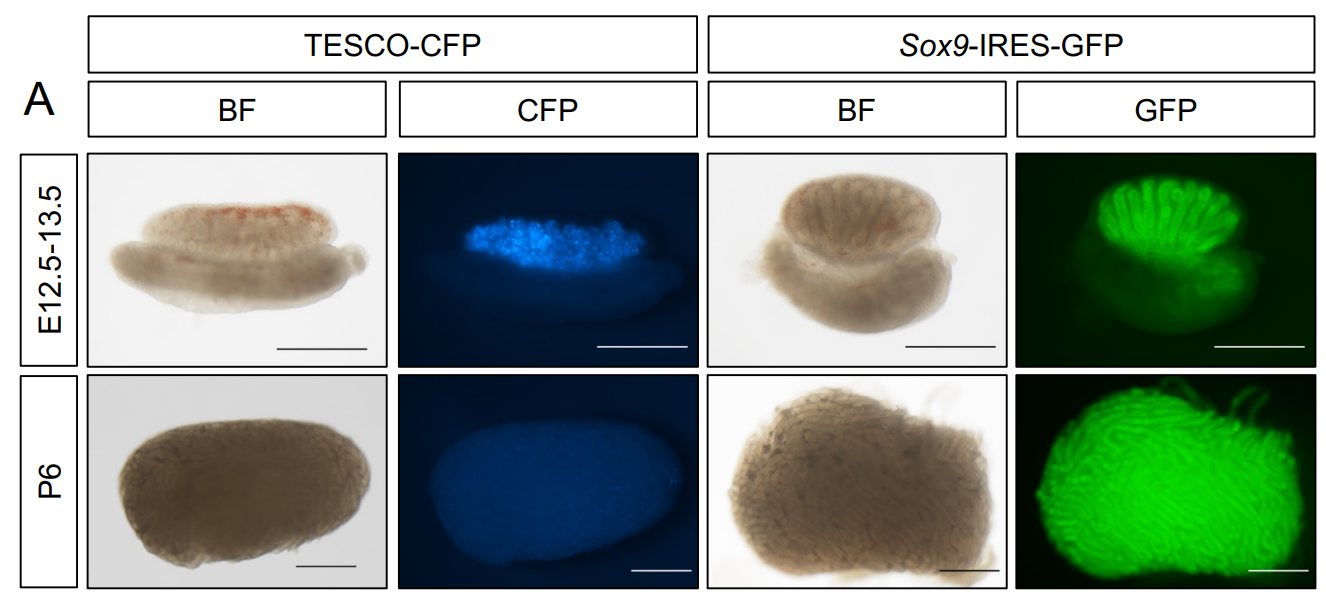
[^补充图1. 用于睾丸采集的支持细胞特异性报告小鼠。]: 明场(BF)和荧光图像显示了来自Sox9-IRES-GFP或TESCO-CFP小鼠的E12.5-13.5胚胎或P6幼崽的睾丸。比例尺:500 μm。
为了开发睾丸类器官,我们选择了P4-7日龄新生幼崽的睾丸,而不是胚胎或成年睾丸。之前的研究表明,成年睾丸无法形成类器官[21],而且与新生幼崽睾丸相比,胚胎性腺的相对较小体积意味着睾丸细胞比理想的大型筛选所需的细胞要少。从Sox9-IRES-GFP或TESCO-CFP小鼠株的P4-P7幼崽中取出整个睾丸,将其分离成单细胞,并在不同的培养基组成的2D或3D培养设置上进行铺板。通过明场(BF)和荧光检查细胞或类器官,基因表达分析和免疫染色(图1A)评估了各种条件的结果。
.jpg)
[^图1. transwell插入物上建立原发性新生儿睾丸类器官。]: (A)实验设计的示意图。将来自P4-P7 Sox9-IRES-GFP或TESCO-CFP幼崽的原代睾丸细胞解离成单细胞,并在各种培养方法和培养基组合物下重新组装。使用 BioRender 创建的方案。(B) 睾丸类器官的代表性明场 (BF) 和荧光图像,来自 Sox9-IRES-GFP 小鼠,在 transwell 插入物上培养 7、14 和 21 天。比例尺,100μm。(C) 在培养的前 4 天内形成的类器官的代表性 BF 和荧光图像。比例尺,100μm。(D)长时间培养的类器官的代表性BF图像。比例尺,500μm。(E) 类器官面积 (mm 2 ) 随培养时间的变化。数据以平均面积±SEM表示。将所有区域与 D7 类器官的区域进行比较。P < 0.05,P < 0.01,P < 0.001,****P < 0.0001,ns - 不显著。N=3-4。
之前描述的用于在标准2D培养板中培养原代睾丸细胞的条件[11]被重新审视并用于基线比较。正如之前所证明的[11],在含有2%胎牛血清的Ad-DMEM/F12培养基中,将原代睾丸细胞种植在塑料明胶涂层的培养皿上并不是维持睾丸细胞的理想条件(补充图2)。这些细胞呈现出成纤维细胞样的形态,GFP或CFP的表达非常微弱,并且没有形成支持细胞的聚集特征(补充图2A)。在培养的第1天、第4天和第7天分析几个支持细胞标志物的表达水平,与未在体外培养的P4-P7原代细胞相比,发现诸如Amh、Cyp26b1、Ptgds等基因的表达急剧下降。其他基因在培养期间的表达不稳定,与新生儿睾丸的正常表达水平不同(补充图2B)。
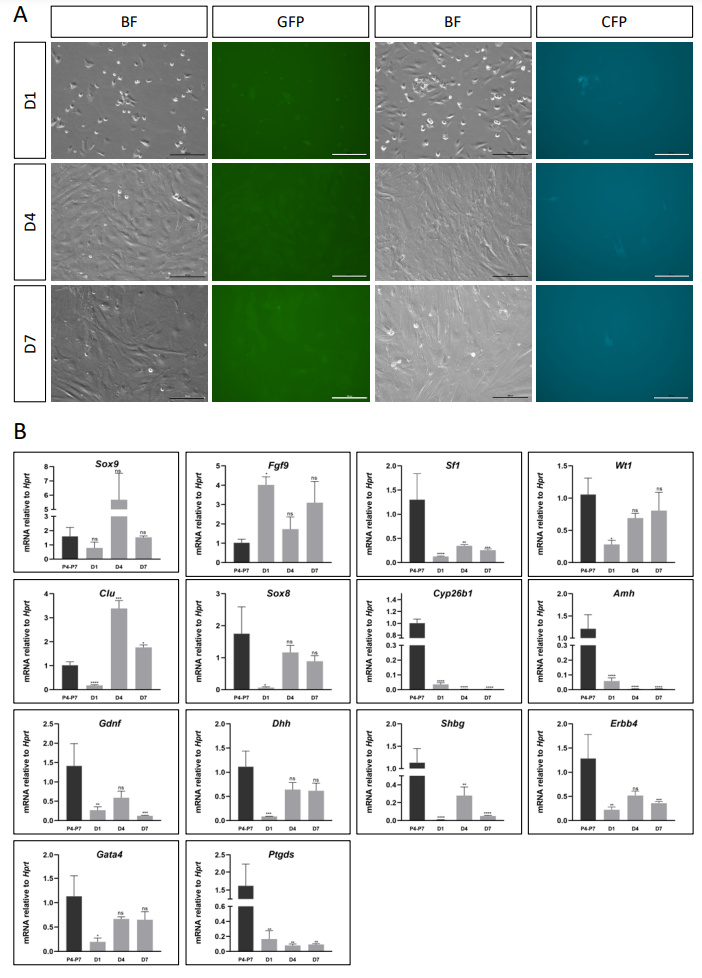
[^补充图2. 在含血清的培养基中培养的睾丸细胞。]: (A) 来自Sox9-IRES-GFP或TESCO-CFP幼崽的睾丸细胞的明场(BF)和荧光图像。这些细胞在含2% FBS的Ad-DMEM/F12培养基中,在0.2%明胶涂层的培养皿上培养7天。比例尺:100 μm。 (B) TESCO-CFP小鼠睾丸细胞在含血清的培养基中培养1-7天的定量PCR(qPCR)分析。数据表示为平均2−ΔΔCt值±SEM,标准化到管家基因Hprt。 *P < 0.05, **P < 0.01, ***P < 0.001, 和 ****P < 0.0001,ns - 不显著。样本量N=3。
大多数类器官系统开发并不使用含血清的培养基,而是采用组织特异性的定制培养基,这种培养基不含血清,而是包含该组织通常存在的特定生长因子[15]。因此,我们的目标是开发一种“睾丸定制培养基”(以下简称“定义培养基”),其中包含根据文献研究通常存在于睾丸中的因子(详细培养基组成见补充表1)。这种培养基包含重组人促卵泡激素(rhFSH)[26]、成纤维细胞生长因子9(FGF9)[27]、前列腺素D2(PGD2)[28, 29]、睾酮[30]和激活素A[27, 31],所有这些因子在睾丸中都有表达并发挥关键作用。有趣的是,在定义培养基中,原代睾丸细胞在明胶涂层的培养皿上培养,与上述使用的含血清培养基相比,细胞形态完全不同(补充图3A)。细胞形成了圆形聚集体,表达CFP/GFP,因此可以被识别为支持细胞。在聚集体下方,有细胞附着在培养皿上,形成一个类似“饲养层”的层,聚集体附着在其上(补充图3A)。尽管细胞形态发生了显著变化,但许多支持细胞标志物的基因表达,如Amh、Cyp26b1、Dhh和Shbg,与原代细胞相比仍然显著降低。其他基因,如Sox9,则更为稳定(补充图3B)。这表明,仅改变培养基,尽管有影响,但还不足以实现原代睾丸细胞的有效且持续培养。
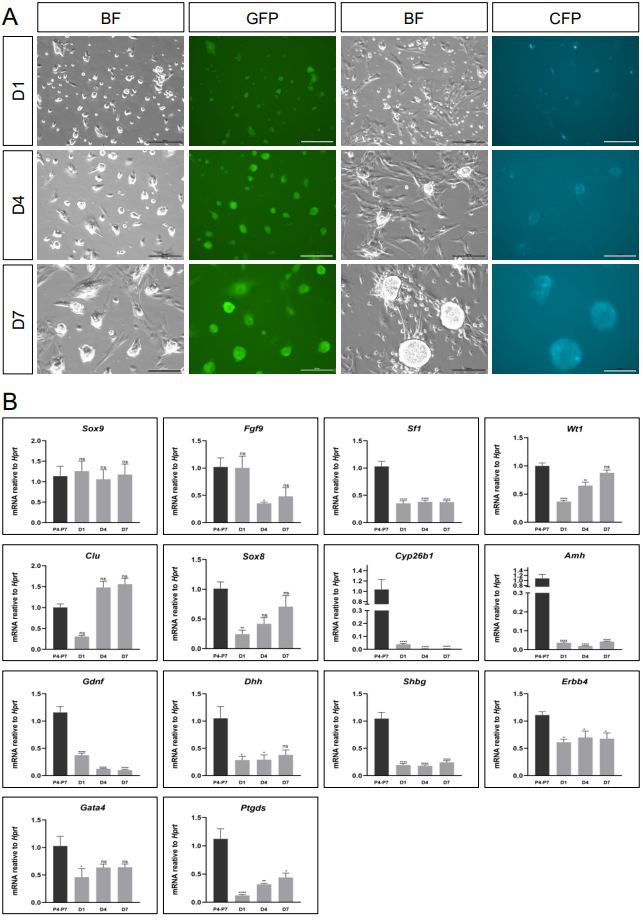
[^补充图3. 在睾丸定义培养基中培养的睾丸细胞。]: (A) 来自Sox9-IRES-GFP或TESCO-CFP幼崽的睾丸细胞的明场(BF)和荧光图像。这些细胞在含睾丸生长因子的定义培养基中,在0.2%明胶涂层的培养皿上培养7天,详细信息见补充表1。比例尺:100 μm。 (B) TESCO-CFP小鼠睾丸细胞在定义培养基中培养1-7天的定量PCR(qPCR)分析。数据表示为平均2−ΔΔCt值±SEM,标准化到管家基因Hprt。
许多类器官系统使用基质胶作为涂层或支架系统,以支持细胞的3D培养[15]。因此,我们尝试在各种稀释的基质胶上接种原代睾丸细胞,并将其与在涂有明胶的孔中生长的细胞进行比较(补充图4A)。明场和荧光显微镜显示,细胞无法形成聚集体,CFP表达非常微弱。qPCR分析显示许多Sertoli标志物的表达较低(补充图4)。因此,在基质胶上接种不能支持培养物中的睾丸细胞生长。
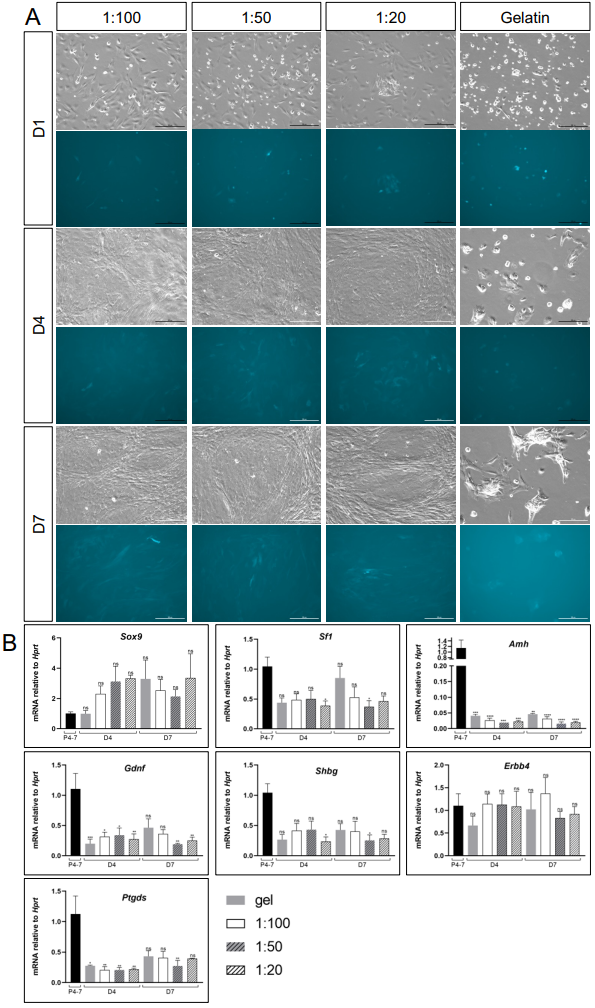
[^补充图4. 在定义培养基中,使用Geltrex涂层培养睾丸细胞。]: (A) TESCO-CFP幼崽的睾丸细胞在各种Geltrex稀释(1:100、1:50和1:20)或0.2%明胶(gel)涂层的孔中培养的明场(BF)和荧光图像。比例尺:100 μm。 (B) TESCO-CFP小鼠睾丸细胞在定义培养基上,使用Geltrex或明胶涂层培养1-7天的定量PCR(qPCR)分析。数据表示为平均2−ΔΔCt值±SEM,标准化到管家基因Hprt。
使用规定的培养基在transwell插入物上培养原代睾丸细胞
由于在不同的2D培养条件下,细胞形态都显得不太理想,我们寻求一个能够更好地支持睾丸类器官形成和维持的3D培养系统。包括肾脏、肺脏、肝脏和脑部类器官在内的几个类器官系统都使用了transwell插入物[32-37]。鉴于肾脏和性腺都起源于中胚层[38],并且它们都具有管状结构,我们探索了使用transwell插入物来生成睾丸类器官(图1A)。为此,我们在transwell插入物上播种每类器官3.5x10^5个原代睾丸细胞,并向井底添加定义好的培养基(见补充表1)。当细胞在transwell插入物上培养时,它们会遇到来自底部的培养基和来自顶部的空气之间的气液界面。非常引人注目的是,细胞形成了清晰的管状结构和非常强烈的CFP或GFP表达,持续了21天(图1B和补充图5)。为了更好地评估类器官形成的早期阶段,在接种后立即接种并连续 4 天检查类器官。播种后一天,类器官就开始压实,到第2天,它们形成了明显压实的类器官。在第 3 天和第 4 天继续进行进一步的压实(图 1C)。这些类器官可以培养长达 9 周 (D63),同时仍保持具有清晰管状结构的致密类器官形态(图 1D)。然而,在培养 9 周后,它们开始崩溃。对类器官面积的测量表明,在整个9周的培养期间,它们的大小继续增长(图1E)。
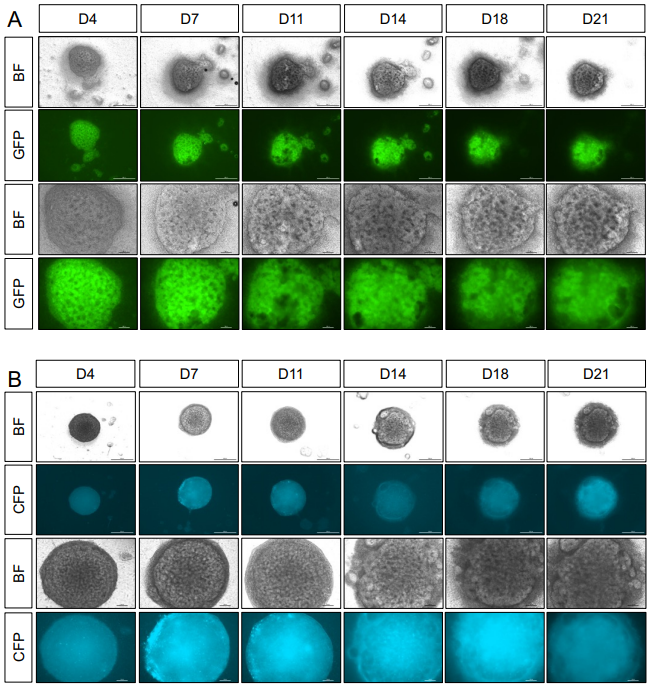
[^补充图5. 在transwell插入物上培养的睾丸新生儿类器官。]: (A) 来自Sox9-IRES-GFP睾丸细胞的类器官的代表性明场(BF)和荧光图像,这些类器官在transwell插入物上培养最多21天。 (B) 来自TESCO-CFP睾丸细胞的类器官的代表性明场(BF)和荧光图像,这些类器官在transwell插入物上培养最多21天。 比例尺:100 μm。
在transwell插入物上培养的睾丸类器官组织成管状结构,让人联想到睾丸
睾丸由两个主要部分组成:睾丸索(后来成为生精小管)和间质区域。睾丸索包含支持细胞和生殖细胞,而间质区域主要由间质细胞和PM细胞组成[5, 39]。为了探究类器官中是否所有主要的睾丸细胞类型都存在,并确定它们的空间组织,我们对培养21天(D21)的类器官进行了免疫染色,使用了各种不同细胞类型的标记物(图3A)。对整个D21类器官进行SOX9、AMH、CLD11(支持细胞)、3ßHSD(间质细胞)、DDX4(生殖细胞)和α-SMA(PM细胞)的免疫染色表明,所有主要的睾丸细胞类型在培养的第21天都在类器官中存在(图3A)。由于类器官是球形的,我们获得了整个染色类器官的多个Z层图像,生成了这些类器官与各种共染色的电影(补充视频1-6)。令人惊讶的是,类器官呈现出与体内睾丸非常相似的空间组织。支持细胞形成了许多管状结构,DDX4阳性的细胞位于支持细胞旁边和管内。显然,生殖细胞倾向于定位在管的外侧,但靠近支持细胞(图3A a-d,补充视频1)。3ßHSD阳性的间质细胞位于SOX9阳性管外的区域,对应于间质区域(图3A e-h,补充视频2)。α-SMA阳性的PM细胞位于支持细胞附近,但不太清楚它们是否确实位于管外,因为它们通常应该位于管外(图3A i-l,补充视频3)。AMH和CLD11的表达强烈,表明存在由支持细胞组成的管状结构,其中包含DDX4阳性的生殖细胞(图3A m-p,补充视频4)。
为了更好地分析睾丸类器官的空间组织,并与体内睾丸进行比较,我们进行了整个D21类器官的免疫染色,并与P28睾丸的免疫染色进行了比较(D21类器官对应于P28,因为它是在P7收获的,并在体外培养了21天)(图3B)。SOX9支持细胞标记物的染色清楚地显示了管状结构的形成,类似于睾丸的管状结构。由多个Z层组成的整个类器官染色电影确认了SOX9(补充视频5)和DAPI染色(补充视频6)的管状结构形成。标记生殖细胞的DDX4表达强烈,生殖细胞似乎聚集在一起。另一方面,3ßHSD免疫染色表明位于管外,与体内睾丸相似。然而,尽管在类器官中α-SMA强烈表达,但它并没有显示出特定的管外定位,正如预期的那样(图3B)。
.jpg)
从胚胎睾丸生成睾丸类器官
尽管从新生幼崽中生成类器官比从胚胎中更为方便,因为不需要从定时怀孕的雌性动物中采集,得到的睾丸较小,细胞数量也较少,但新生幼崽的类器官存在限制,因为许多与睾丸发育和功能障碍相关的疾病发生在胚胎阶段(DSD)。因此,为了研究DSD,我们首选从胚胎中获得的类器官。因此,我们采用了之前为新生幼崽睾丸类器官建立的同一路径,用于从胚胎性腺生成睾丸类器官。我们收集了E12.5-E14.5胚胎的睾丸,将其分离成单细胞,并在定义好的培养基中播种在transwell插入物上。由胚胎来源的睾丸细胞形成的类器官具有非常明显和清晰的管状结构,这比使用新生幼崽睾丸观察到的要清楚得多。图4A展示了在培养14天后三个不同的胚胎睾丸类器官。右侧面板显示了来自Sox9-IRES-GFP株的类器官的GFP荧光。GFP存在于管状结构中,表明这些管状结构是由支持细胞形成的(图4A)。
为了更好地了解在体外培养14天的胚胎睾丸类器官,我们整个D14类器官进行了免疫染色,以标记不同性腺细胞类型的标记物(图4B)。类器官对SOX9的染色非常强烈,这些SOX9阳性的细胞形成了管状结构。TRA98,用于标记生殖细胞,也被表达,表明生殖细胞的存在。此外,3ßHSD的表达明显,主要位于SOX9阳性管状结构的外部,在间质中,正如间质细胞预期的那样(图4B)。这些数据表明,transwell系统与定义好的培养基相结合,适合形成保持大多数性腺细胞类型的胚胎和新生幼崽睾丸类器官,这些类器官在长时间内高度类似于睾丸的组成部分和结构。
.jpg)
[^图4.从胚胎睾丸建立类器官培养。]: (A) 从 E12.5-E14.5 胚胎睾丸中收获并培养 14 天的类器官的代表性 BF 和荧光图像。左边的两张图片(TESCO-CFP)在规定的培养基上培养,右边的两张图片(Sox9-IRES-GFP)在未成熟的培养基上培养。比例尺,500μm。(B) 对培养 14 天的胚胎类器官中主要类型睾丸细胞的标志物进行全安装免疫染色。SOX9(支持细胞)、TRA98(淋巴细胞)、3ßHSD(间质细胞)。比例尺,100μm。
开发培养基组合物以支持支持细胞的未成熟和成熟状态
我们已经证明了transwell系统可以支持胚胎和新生幼崽睾丸类器官的形成,因此我们试图在这个系统中培养成熟的睾丸,这将使我们能够研究成年睾丸的疾病,比如不育症。我们从90天大的成熟睾丸中获取睾丸细胞,并在transwell插入物上进行播种。与胚胎和新生幼崽睾丸不同,成年睾丸细胞无法形成类器官(补充图6)。这与之前在3D条件下培养成年睾丸类器官的失败尝试[21]一致。作为一种替代方法,我们尝试通过修改定义好的培养基来使新生幼崽睾丸类器官成熟到成年睾丸状态。
在胚胎阶段,睾丸由包含生殖细胞的睾丸索组成,周围环绕着未成熟的支持细胞和周管肌样细胞。未成熟的支持细胞具有自然的增殖能力(图5A)。在青春期,生殖细胞迁移到基底膜附近并转变为精原干细胞(SSC)。支持细胞经历成熟过程,这促进了它们的极化并建立了血睾屏障。大量极化的支持细胞与不同阶段的精细胞接触,后者经历减数分裂(图5A)。
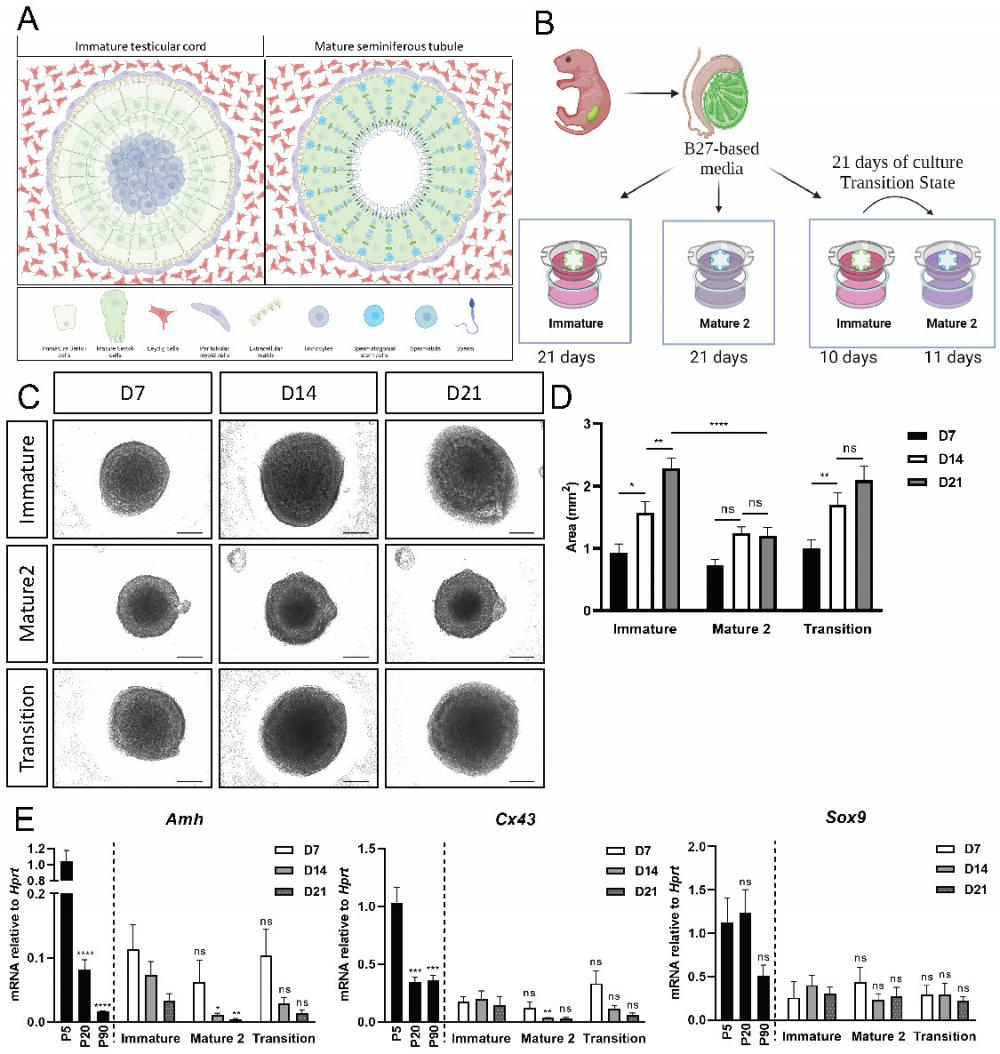
[^图5. 不同培养基组成中新生幼崽类器官的体外成熟。]: (A) 青春期前(左侧面)和成人睾丸(右侧面)的示意图。青春期前睾丸的睾丸索被间质中的周管肌样细胞和间质细胞环绕。生殖细胞位于索的中心,被未成熟的支持细胞所包围。青春期后和成年,生精小管被周管肌样细胞和成熟的间质细胞所环绕。此时的生殖细胞被称为精原干细胞(SSC),位于管的基底侧,靠近基底膜。随着SSC分化并经历减数分裂,它们从管的基底侧迁移到管腔侧。使用BioRender创建的示意图。 (B) 实验设计的示意图。来自P4-P7 Sox9-IRES-GFP或TESCO-CFP小鼠的原代睾丸细胞被分离成单细胞,并在transwell插入物上重新组装,并在不成熟或成熟2号培养基中培养21天。还采用了一种“过渡”方案,其中类器官在前10天在不成熟培养基中培养,然后过渡到成熟2号培养基再培养11天,总共培养21天。使用BioRender创建的示意图。 © 使用不成熟、成熟2号或过渡方案培养21天的类器官的代表性明场图像。比例尺,500 μm。 (D) 使用不成熟、成熟2号或过渡方案培养21天的类器官的面积随时间变化。数据表示为平均面积±SEM。*P < 0.05, ****P < 0.0001, ns - 不显著。N=9-14。 (E) 随着时间的推移,使用不成熟、成熟2号或过渡方案培养21天的类器官中支持细胞标记物的定量PCR分析,与P5、P20和P90体内睾丸比较。数据表示为平均2-ΔΔCt值±SEM,标准化到管家基因Hprt.*P < 0.05,
以往的研究已经鉴定出许多分泌分子、激素和信号通路,它们支持支持细胞的幼稚(增殖)状态或成熟状态,后者建立血睾屏障并促进精子发生。维持和增强幼稚状态的因素包括FSH、类胰岛素生长因子I(IGF-1)、激活素A和FGF9。促进成熟支持细胞状态的因素包括雄激素、甲状腺激素(TH)和视黄酸(RA)[40]。基于这些因素,我们开发了三种不同的培养基配方:一种支持维持幼稚支持细胞状态(幼稚培养基),两种替代培养基促进维持成熟支持细胞状态(成熟1号和成熟2号培养基)。各种培养基配方在基于B27或Knockout血清替代物(KSR)的培养基上进行了测试(补充图7A和补充表1)。选择B27,因为它是许多类型的类器官定义培养基的基本添加物[41],选择KSR是因为它已经被添加到几种睾丸细胞培养基中[42, 43]。所有培养基配方都与研究中使用的原始定义培养基进行了比较(含有B27,详见补充表1)。
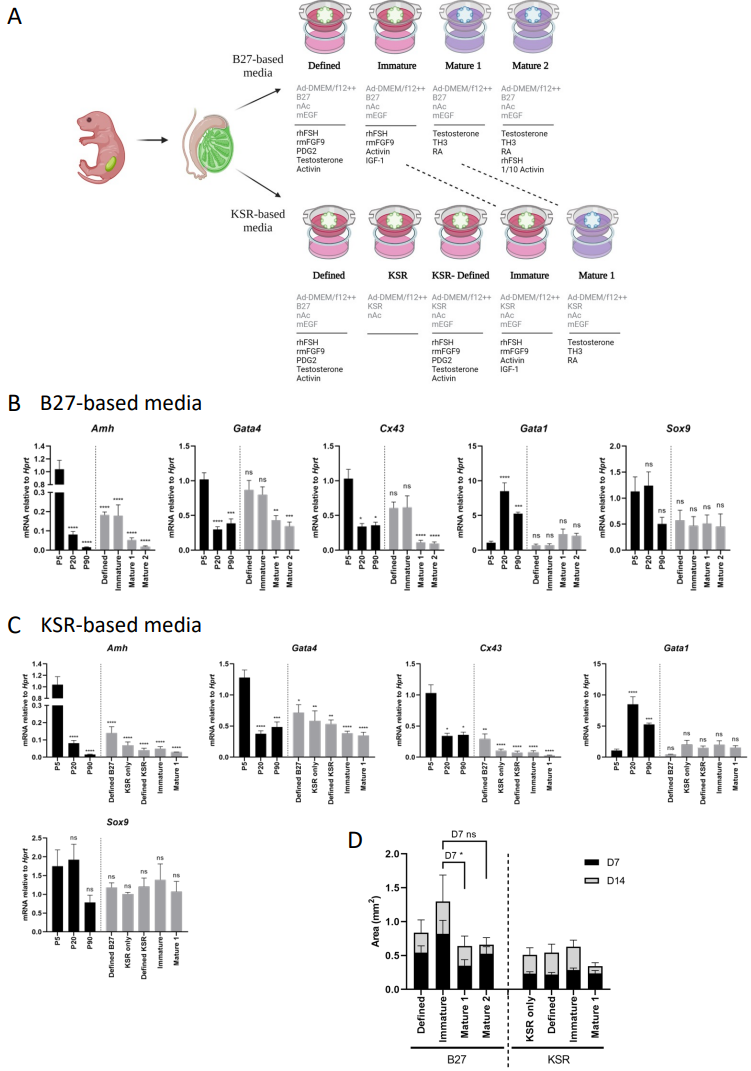
[^补充图7. 优化睾丸类器官幼稚和成熟状态的培养基组成。]: (A) 基于B27或KSR的培养基组成的示意图。不变的添加物用灰色标记,每种培养基添加的生长因子用黑色标记。完整的培养基配方见补充表1。使用BioRender创建的示意图。 (B) 14天在基于B27的培养基中培养的类器官中支持细胞标记物的定量PCR分析,与体内P5、P20和P90睾丸比较。数据表示为平均2-ΔΔCt值±SEM,标准化到管家基因Hprt。 *P < 0.05, **P < 0.01, ***P < 0.001, 和 ****P < 0.0001,ns - 不显著。N=4-5。 © 14天在基于KSR的培养基中培养的类器官中支持细胞标记物的定量PCR分析,与体内P5、P20和P90睾丸比较。数据表示为平均2-ΔΔCt值±SEM,标准化到管家基因Hprt。 *P < 0.05, **P < 0.01, ***P < 0.001, 和 ****P < 0.0001,ns - 不显著。N=4-5。 (D) 在B27和KSR基础培养基上的类器官在第7天和第14天的面积。第7天的条形图是黑色的,第14天的条形图是累积的并且阴影为灰色。数据表示为平均面积±SEM。第7天培养的成熟1号和成熟2号与幼稚型培养基的统计显著性显示。 *P < 0.05, ns - 不显著。N=5-8。
为了测试各种培养基配方促进幼稚与成熟支持细胞状态的能力,使用定量PCR(qPCR)测量了在幼稚和成熟状态下表达水平不同的支持细胞标记物的表达水平。为了验证测试的标记物实际上在一种状态下比另一种状态更高地表达,首先评估了P5、P20和P90整个睾丸的表达。Amh、Gata4和Cx43在P5睾丸中的表达显著高于成人睾丸,即标记幼稚支持细胞状态,而Gata1在成人睾丸中的表达更高,标记成熟支持细胞(补充图7B-C)。Sox9在这两种状态之间没有显著变化,作为对照。分析在定义的、幼稚的或两种成熟型培养基中培养14天的类器官中Amh、Gata4和Cx43的表达水平,所有三种幼稚状态标记物的表达水平均较高,而两种成熟型培养基导致显著较低的表达水平。相比之下,分析Gata1的表达结果在两种成熟型培养基中均高于幼稚型和定义型培养基,尽管这没有统计学意义。这表明含有B27的幼稚培养基能够促进幼稚支持细胞状态,而含有B27的成熟培养基更擅长促进成熟支持细胞状态(补充图7B)。
对在特定培养基(含 B27)、仅 KSR(未添加生长因子)、含 KSR 的特定 KSR、未成熟和成熟培养基中生长 14 天的类器官进行了类似的分析。与基于 B27 的未成熟培养基和成熟培养基之间观察到的各种标记物表达的变化不同,当使用基于 KSR 的培养基的不同组合时,未观察到 Amh、Gata4、Cx43 和 Gata1 的表达发生显着变化(补充图 7C)。这表明,将KSR添加到培养基中掩盖了添加到培养基中以促进不同细胞状态的生长因子的作用。
接下来,我们确定了使用各种B27基础和KSR基础培养基培养14天的类器官的大小。与qPCR观察到的结果一致,幼稚型的B27基础培养基能够促进幼稚状态,导致D7和D14时类器官显著增大,而两种成熟型的B27基础培养基导致D7和D14时类器官大小减小(补充图7D,左侧)。相比之下,当类器官在KSR基础培养基上培养时,无论是在D7还是D14,类器官的大小都没有明显变化(补充图7D,右侧)。基于这些结果,我们决定继续使用B27基础培养基。
在体内,睾丸保持幼稚状态直到大约P15,此后过渡到成熟的Sertoli状态并开始精子发生。我们因此开发了一个方案,其中P5新生幼崽的睾丸被收获,在幼稚型培养基中培养10天(模拟P15阶段),然后转移到成熟型培养基中再培养11天,总共培养21天(图5B,“过渡状态”)。作为对照,类器官仅在幼稚型或成熟型培养基中培养21天。
测量了培养D7、D14和D21时类器官的大小。仅在幼稚型培养基中培养的类器官从D7到D14,从D14到D21显著增长(图5C,D)。相比之下,仅在成熟2号培养基中培养的类器官在D7到D21之间没有显示出大小增长。有趣的是,处于过渡培养基中的类器官从D7到D14显著增长,当时它们主要在幼稚型培养基中培养,然后在D14到D21之间在成熟2号培养基中培养时,没有显示出显著的大小增长(图5C-D)。
睾丸类器官允许SSC进入减数分裂
睾丸的主要功能之一是支持精子生成和单倍体精子的产生。精子生成是一个漫长的过程,其中二倍体精原干细胞经历减数分裂形成单倍体圆形精子原细胞,这些细胞将经历精子生成过程,产生头部前部有顶体盖的成熟精子。减数分裂的一个标志是双链断裂(DSB)的形成和姐妹染色单体之间遗传物质的配对重组[45]。为了确定类器官是否支持精原干细胞进入减数分裂,首先在定义好的培养基上培养的D21类器官被共染色,使用减数分裂标记物γH2AX,它标记DSB,以及DDX4,它标记精原干细胞和精原细胞的所有阶段。γH2AX焦点通常存在于间变型和B型精原干细胞以及前孢子母细胞到合子细胞阶段。A型精原干细胞和圆形精子原细胞也着色于γH2AX,但为均匀的核着色[46, 47]。
.jpg)
[^图6. SSC在体外类器官中进入减数分裂。]: (A) 在定义的培养基中培养的D21类器官的整体免疫染色,用γH2AX(减数分裂细胞的标记)和DDX4(标记所有生殖细胞)进行染色。比例尺:100 μm。插入图是方框区域的放大视图。 (B) 随着时间的推移,在定义的培养基中培养的睾丸类器官中Acrozin的定量PCR分析,与体内P5、P28和P90睾丸比较。数据表示为平均2-ΔΔCt值±SEM,标准化到管家基因Hprt。 在过渡培养基上培养的D7和D42类器官的整体免疫染色,用γH2AX和DDX4进行染色。白色箭头表示γH2AX和DDX4的共染色。比例尺:100 μm。 (D) 5、28、90 dpp小鼠睾丸切片的免疫染色。切片用REC8(标记减数分裂细胞中的共价复合体亚基)和DDX4(标记所有生殖细胞)进行染色。REC8表达仅在28和90 dpp的特定生精小管中,由白色箭头指示。 (E) 在过渡培养基上培养的D7、D21和D42类器官的整体免疫染色,用REC8和DDX4进行染色。白色箭头表示REC8和DDX4的共染色。比例尺:100 μm。
图6A表明,一些DDX4阳性细胞也是γH2AX阳性,提示细胞可能在类器官内体外进入减数分裂。减数分裂存在的另一个迹象来自Acrosin的表达分析,Acrosin是一种仅在成熟精子头部顶体中表达的基因。虽然P4-P7睾丸在任何阶段都不显示Acrosin表达,因为减数分裂尚未开始,但P28和P90睾丸显示出非常高的Acrosin表达水平(图6B)。有趣的是,体外睾丸类器官表现出低水平的Acrosin表达,主要在D21-D42阶段。虽然这种表达水平与体内睾丸相比非常低,但其时间依赖性的存在可能表明在类器官培养的后期阶段存在少量完全成熟的精子(图6B)。接下来,我们分析了是否D7和D42类器官,在过渡培养基上培养,也呈现DDX4和γH2AX的共染色。如图6C所示,尽管D7类器官中只有少数细胞呈现共染色,但在D42类器官中许多细胞呈现共染色。
γH2AX可以标记精原细胞,但它也可以标记具有DSB的细胞,因此,为了验证类器官中的SSC确实进入了减数分裂,我们分析了REC8的存在,REC8是共价复合体的一个亚基,它在减数分裂期间发挥作用[48, 49]。我们首先用REC8和DDX4染色5、28和90天大的睾丸切片。如预期,5天大的睾丸切片中没有REC8表达,但在28和90天大的睾丸切片中的特定生精小管中可以看到大量的REC8,这确认了抗体的特异性(图6D)。接下来,我们在过渡培养基中培养的D7、D21和D42类器官上进行了整个染色,使用REC8和DDX4。虽然在D7类器官中没有重叠,但在D21和D42类器官中可以看到双阳性细胞。总的来说,这些发现表明体外类器官培养可以支持SSC进入减数分裂,其中一些甚至可能完成精子发生并形成含有ACROSIN的精子头。
Reference
Wilhelm D, Palmer S, Koopman P. Sex determination and gonadal development in mammals. Physiol Rev. 2007;87:1-28
Rotgers E, Jorgensen A, Yao HH. At the Crossroads of Fate-Somatic Cell Lineage Specification in the Fetal Gonad. Endocr Rev. 2018;39:739-59
Nef S, Stevant I, Greenfield A. Characterizing the bipotential mammalian gonad. Curr Top Dev Biol. 2019;134:167-94
Gonen N, Lovell-Badge R. The regulation of Sox9 expression in the gonad. Curr Top Dev Biol. 2019;134:223-52
Maatouk DM, Capel B. Sexual development of the soma in the mouse. Curr Top Dev Biol. 2008;83:151-83
Fayomi AP, Orwig KE. Spermatogonial stem cells and spermatogenesis in mice, monkeys and men. Stem Cell Res. 2018;29:207-14
Bashamboo A, Eozenou C, Rojo S, McElreavey K. Anomalies in human sex determination provide unique insights into the complex genetic interactions of early gonad development. Clin Genet. 2017;91:143-56
Delot EC, Vilain E. Towards improved genetic diagnosis of human differences of sex development. Nat Rev Genet. 2021;22:588-602
Organization WH. Infertility prevalence estimates, 1990-2021. Licence: CC BY-NC-SA 30 IGO. 2023
Tuttelmann F, Ruckert C, Ropke A. Disorders of spermatogenesis: Perspectives for novel genetic diagnostics after 20 years of unchanged routine. Med Genet. 2018;30:12-20
Buganim Y, Itskovich E, Hu YC, Cheng AW, Ganz K, Sarkar S. et al. Direct reprogramming of fibroblasts into embryonic Sertoli-like cells by defined factors. Cell Stem Cell. 2012;11:373-86
Beverdam A, Wilhelm D, Koopman P. Molecular characterization of three gonad cell lines. Cytogenet Genome Res. 2003;101:242-9
Bashamboo A, Eozenou C, Jorgensen A, Bignon-Topalovic J, Siffroi JP, Hyon C. et al. Loss of Function of the Nuclear Receptor NR2F2, Encoding COUP-TF2, Causes Testis Development and Cardiac Defects in 46,XX Children. Am J Hum Genet. 2018;102:487-93
Miyado M, Inui M, Igarashi M, Katoh-Fukui Y, Takasawa K, Hakoda A. et al. The p.R92W variant of NR5A1/Nr5a1 induces testicular development of 46,XX gonads in humans, but not in mice: phenotypic comparison of human patients and mutation-induced mice. Biol Sex Differ. 2016;7:56
Lancaster MA, Knoblich JA. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 2014;345:1247125
Lara N, Sakib S, Dobrinski I. Regulation of Cell Types Within Testicular Organoids. Endocrinology. 2021 162
Oliver E, Stukenborg JB. Rebuilding the human testis in vitro. Andrology. 2020;8:825-34
AbuMadighem A, Shuchat S, Lunenfeld E, Yossifon G, Huleihel M. Testis on a chip-a microfluidic three-dimensional culture system for the development of spermatogenesisin-vitro. Biofabrication. 2022 14
Alves-Lopes JP, Soder O, Stukenborg JB. Testicular organoid generation by a novel in vitro three-layer gradient system. Biomaterials. 2017;130:76-89
Baert Y, De Kock J, Alves-Lopes JP, Soder O, Stukenborg JB, Goossens E. Primary Human Testicular Cells Self-Organize into Organoids with Testicular Properties. Stem Cell Reports. 2017;8:30-8
Edmonds ME, Woodruff TK. Testicular organoid formation is a property of immature somatic cells, which self-assemble and exhibit long-term hormone-responsive endocrine function. Biofabrication. 2020;12:045002
Sakib S, Uchida A, Valenzuela-Leon P, Yu Y, Valli-Pulaski H, Orwig K. et al. Formation of organotypic testicular organoids in microwell culturedagger. Biol Reprod. 2019;100:1648-60
Rezaei Topraggaleh T, Rezazadeh Valojerdi M, Montazeri L, Baharvand H. A testis-derived macroporous 3D scaffold as a platform for the generation of mouse testicular organoids. Biomater Sci. 2019;7:1422-36
Sekido R, Lovell-Badge R. Sex determination involves synergistic action of SRY and SF1 on a specific Sox9 enhancer. Nature. 2008;453:930-4
Furuyama K, Kawaguchi Y, Akiyama H, Horiguchi M, Kodama S, Kuhara T. et al. Continuous cell supply from a Sox9-expressing progenitor zone in adult liver, exocrine pancreas and intestine. Nat Genet. 2011;43:34-41
Buzzard JJ, Wreford NG, Morrison JR. Marked extension of proliferation of rat Sertoli cells in culture using recombinant human FSH. Reproduction. 2002;124:633-41
Gustin SE, Stringer JM, Hogg K, Sinclair AH, Western PS. FGF9, activin and TGFbeta promote testicular characteristics in an XX gonad organ culture model. Reproduction. 2016;152:529-43
Wilhelm D, Martinson F, Bradford S, Wilson MJ, Combes AN, Beverdam A. et al. Sertoli cell differentiation is induced both cell-autonomously and through prostaglandin signaling during mammalian sex determination. Dev Biol. 2005;287:111-24
Malki S, Nef S, Notarnicola C, Thevenet L, Gasca S, Mejean C. et al. Prostaglandin D2 induces nuclear import of the sex-determining factor SOX9 via its cAMP-PKA phosphorylation. EMBO J. 2005;24:1798-809
Buzzard JJ, Wreford NG, Morrison JR. Thyroid hormone, retinoic acid, and testosterone suppress proliferation and induce markers of differentiation in cultured rat sertoli cells. Endocrinology. 2003;144:3722-31
Buzzard JJ, Farnworth PG, De Kretser DM, O’Connor AE, Wreford NG, Morrison JR. Proliferative phase sertoli cells display a developmentally regulated response to activin in vitro. Endocrinology. 2003;144:474-83
Takasato M, Er PX, Chiu HS, Little MH. Generation of kidney organoids from human pluripotent stem cells. Nat Protoc. 2016;11:1681-92
Takasato M, Er PX, Chiu HS, Maier B, Baillie GJ, Ferguson C. et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 2015;526:564-8
Sontheimer-Phelps A, Hassell BA, Ingber DE. Modelling cancer in microfluidic human organs-on-chips. Nat Rev Cancer. 2019;19:65-81
Fedele G, Cazzaniga A, Castiglioni S, Locatelli L, Tosoni A, Nebuloni M, Maier JAM. The presence of BBB hastens neuronal differentiation of cerebral organoids - The potential role of endothelial derived BDNF. Biochem Biophys Res Commun. 2022;626:30-7
Zhao F, Wang J, Wang Q, Hou Z, Zhang Y, Li X. et al. Organoid technology and lung injury mouse models evaluating effects of hydroxychloroquine on lung epithelial regeneration. Exp Anim. 2022;71:316-28
Li P, Li Y, Wang Y, Liu J, Lavrijsen M, Li Y. et al. Recapitulating hepatitis E virus-host interactions and facilitating antiviral drug discovery in human liver-derived organoids. Sci Adv. 2022;8:eabj5908
Capel B. The role of Sry in cellular events underlying mammalian sex determination. Curr Top Dev Biol. 1996;32:1-37
Stevant I, Nef S. Genetic Control of Gonadal Sex Determination and Development. Trends Genet. 2019;35:346-58
Meroni SB, Galardo MN, Rindone G, Gorga A, Riera MF, Cigorraga SB. Molecular Mechanisms and Signaling Pathways Involved in Sertoli Cell Proliferation. Front Endocrinol (Lausanne). 2019;10:224
Huch M, Dorrell C, Boj SF, van Es JH, Li VS, van de Wetering M. et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature. 2013;494:247-50
Fayaz MA, Honaramooz A. Culture media and supplements affect proliferation, colony-formation, and potency of porcine male germ cells. Theriogenology. 2022;187:227-37
Gholami K, Pourmand G, Koruji M, Sadighigilani M, Navid S, Izadyar F, Abbasi M. Efficiency of colony formation and differentiation of human spermatogenic cells in two different culture systems. Reprod Biol. 2018;18:397-403
Sararols P, Stevant I, Neirijnck Y, Rebourcet D, Darbey A, Curley MK. et al. Specific Transcriptomic Signatures and Dual Regulation of Steroidogenesis Between Fetal and Adult Mouse Leydig Cells. Front Cell Dev Biol. 2021;9:695546
Murakami H, Keeney S. Regulating the formation of DNA double-strand breaks in meiosis. Genes Dev. 2008;22:286-92
Hamer G, Roepers-Gajadien HL, van Duyn-Goedhart A, Gademan IS, Kal HB, van Buul PP, de Rooij DG. DNA double-strand breaks and gamma-H2AX signaling in the testis. Biol Reprod. 2003;68:628-34
Tadokoro Y, Yomogida K, Yagura Y, Yamada S, Okabe M, Nishimune Y. Characterization of histone H2A.X expression in testis and specific labeling of germ cells at the commitment stage of meiosis with histone H2A.X promoter-enhanced green fluorescent protein transgene. Biol Reprod. 2003;69:1325-9
Bannister LA, Reinholdt LG, Munroe RJ, Schimenti JC. Positional cloning and characterization of mouse mei8, a disrupted allelle of the meiotic cohesin Rec8. Genesis. 2004;40:184-94
Biswas U, Hempel K, Llano E, Pendas A, Jessberger R. Distinct Roles of Meiosis-Specific Cohesin Complexes in Mammalian Spermatogenesis. PLoS Genet. 2016;12:e1006389
Franca LR, Hess RA, Dufour JM, Hofmann MC, Griswold MD. The Sertoli cell: one hundred fifty years of beauty and plasticity. Andrology. 2016;4:189-212
Cool J, DeFalco TJ, Capel B. Vascular-mesenchymal cross-talk through Vegf and Pdgf drives organ patterning. Proc Natl Acad Sci U S A. 2011;108:167-72
Potter SJ, DeFalco T. Role of the testis interstitial compartment in spermatogonial stem cell function. Reproduction. 2017;153:R151-R62
Low JH, Li P, Chew EGY, Zhou B, Suzuki K, Zhang T. et al. Generation of Human PSC-Derived Kidney Organoids with Patterned Nephron Segments and a De Novo Vascular Network. Cell Stem Cell. 2019;25:373-87 e9
Pham MT, Pollock KM, Rose MD, Cary WA, Stewart HR, Zhou P. et al. Generation of human vascularized brain organoids. Neuroreport. 2018;29:588-93
Oakberg EF. Duration of spermatogenesis in the mouse and timing of stages of the cycle of the seminiferous epithelium. Am J Anat. 1956;99:507-16
Hogg K, Western PS. Differentiation of Fetal Male Germline and Gonadal Progenitor Cells Is Disrupted in Organ Cultures Containing Knockout Serum Replacement. Stem Cells Dev. 2015;24:2899-911
Clevers H. Modeling Development and Disease with Organoids. Cell. 2016;165:1586-97
Hayashi K, Ohta H, Kurimoto K, Aramaki S, Saitou M. Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell. 2011;146:519-32
Hayashi K, Saitou M. Generation of eggs from mouse embryonic stem cells and induced pluripotent stem cells. Nat Protoc. 2013;8:1513-24
Gonen N, Eozenou C, Mitter R, Elzaiat M, Stevant I, Aviram R. et al. In vitro cellular reprogramming to model gonad development and its disorders. Sci Adv. 2023;9:eabn9793
Knarston IM, Pachernegg S, Robevska G, Ghobrial I, Er PX, Georges E. et al. An In Vitro Differentiation Protocol for Human Embryonic Bipotential Gonad and Testis Cell Development. Stem Cell Reports. 2020;15:1377-91
Yoshino T, Suzuki T, Nagamatsu G, Yabukami H, Ikegaya M, Kishima M. et al. Generation of ovarian follicles from mouse pluripotent stem cells. Science. 2021;373:eabe0237
Mottram R, Feltbower R, Hayden C, Lane S, Mitchell R, Anderson R, Glaser A. Fertility and reproductive health after ovarian and testicular tissue storage: The United Kingdom Registry Study of young people (UKSTORE). Archives of Disease in Childhood. 2023;108:A288-A9
Strange DP, Zarandi NP, Trivedi G, Atala A, Bishop CE, Sadri-Ardekani H, Verma S. Human testicular organoid system as a novel tool to study Zika virus pathogenesis. Emerg Microbes Infect. 2018;7:82
Saitou M, Miyauchi H. Gametogenesis from Pluripotent Stem Cells. Cell Stem Cell. 2016;18:721-35
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/10/迈向培养皿中的睾丸:生成概括睾丸结构和表达谱的小鼠睾丸类器官/
- 版权声明: 转载请注明出处,谢谢。

