来源:SM Shingo Miyawaki YO Yohei Okada HO Hideyuki Okano KM Kyoko Miura
发布: 2017年08月20日第7卷第16期 DOI: 10.21769/BioProtoc.2518
评审: Andrea PuharKevin Patrick O’Rourke 匿名评审
Abstract
多能干细胞,如诱导多能干细胞(iPSCs)和胚胎干细胞(ESCs),在移植到免疫缺陷小鼠体内时,会形成畸胎瘤。由于畸胎瘤包含所有三个原始胚层(内胚层、中胚层和外胚层),畸胎瘤形成实验广泛用作多能性的指标(Evans和Kaufman,1981;Hentze等人,2009;Gropp等人,2012)。另一方面,形成畸胎瘤的肿瘤生成性也代表了阻碍多能干细胞潜在临床应用的主要风险因素(Miura等人,2009;Okano等人,2013)。最近,研究人员报告了来自裸鼹鼠的iPSCs在移植到非肥胖糖尿病/严重联合免疫缺陷(NOD/SCID)小鼠的睾丸时,由于这种物种特有的ES细胞表达的Ras(ERAS)和选择性阅读框架(ARF)依赖的肿瘤抑制机制,缺乏形成畸胎瘤的肿瘤生成性(Miyawaki等人,2016)。在这里,研究人员描述了一种将多能干细胞移植到NOD/SCID小鼠睾丸中以生成畸胎瘤的方法,用于评估多能性和肿瘤生成性。
Background
iPSCs和ESCs在再生医学的细胞移植治疗领域有着广泛的应用前景。但是,当这些细胞被移植到免疫缺陷小鼠体内时,它们可能会形成包含多种分化组织的畸胎瘤,这种肿瘤形成的风险限制了它们的临床应用。已有研究报道了一些方法来降低这种风险(Itakura等人,2017;Vazquez-Martin等人,2012)。研究人员最近的研究发现,来自裸鼹鼠的iPSCs在移植到NOD/SCID小鼠的睾丸时,由于该物种特有的肿瘤抑制因子ARF的激活和癌基因ERAS的突变,不会形成畸胎瘤(Miyawaki等人,2016)。本方案中,研究人员介绍了一种将多能干细胞移植到NOD/SCID小鼠睾丸中的方法,用于生成畸胎瘤。这种方法可以减少免疫排斥,因为睾丸-血液屏障的存在(Cheng和Mruk,2012)。此外,即使移植的细胞没有形成肿瘤,它们在注射部位周围也容易被识别,这是该方法的一个优势。因此,本技术对于评估多能干细胞的多能性和肿瘤生成性非常有用。
Materials and Reagents
15毫升Falcon锥形管(康宁公司,Falcon®品牌,目录号:352196):用于细胞培养和储存。
1.5毫升BIO-BIK离心管(Ina-optika公司,目录号:CF-0150):用于细胞分离和储存。
26号针头(Terumo Medical公司,目录号:NN-2613S):用于细胞注射。
实验室用擦拭纸(Kimwipes,Kimberly-Clark公司,目录号:62011):用于清洁和消毒实验室设备。
0.22微米过滤器单元(TPP Techno Plastic Products,目录号:99155):用于过滤和净化细胞培养基。
10厘米组织培养皿(康宁公司,Falcon®品牌,目录号:353046):用于细胞培养。
表达荧光标记(如GFP)的多能干细胞:便于在移植后追踪和检测细胞。
无菌PBS(NACALAI T
Equipment
两台加湿的5% CO2细胞培养孵箱:32°C用于NMR iPSCs,37°C用于小鼠和人类iPSCs(Thermo Fisher Scientific,Thermo ScientificTM,型号:HeracellTM 150i),用于在控制的环境下培养细胞。
离心机(TOMY DIGITAL BIOLOGY,型号:AX-501),用于分离细胞和细胞碎片。
库尔特计数器(Beckman Coulter,目录号:6605698),用于准确计数细胞。
异氟醚蒸发器、室和鼻锥(Shinano,目录号:SN-487-0T),用于给实验动物提供麻醉。
加热垫(Nissin,型号:NHP-M30N),用于维持实验动物的体温。
手术剪和镊子(见图1),用于进行精细的手术操作。
25 µl汉密尔顿注射器(Hamilton,型号:702 N,目录号:80400),用于精确注射细胞悬液。
微量天平(Shimadzu,型号:ATX84),用于精确称量化学品。
冰箱,用于储存需要低温保存的试剂和样本。
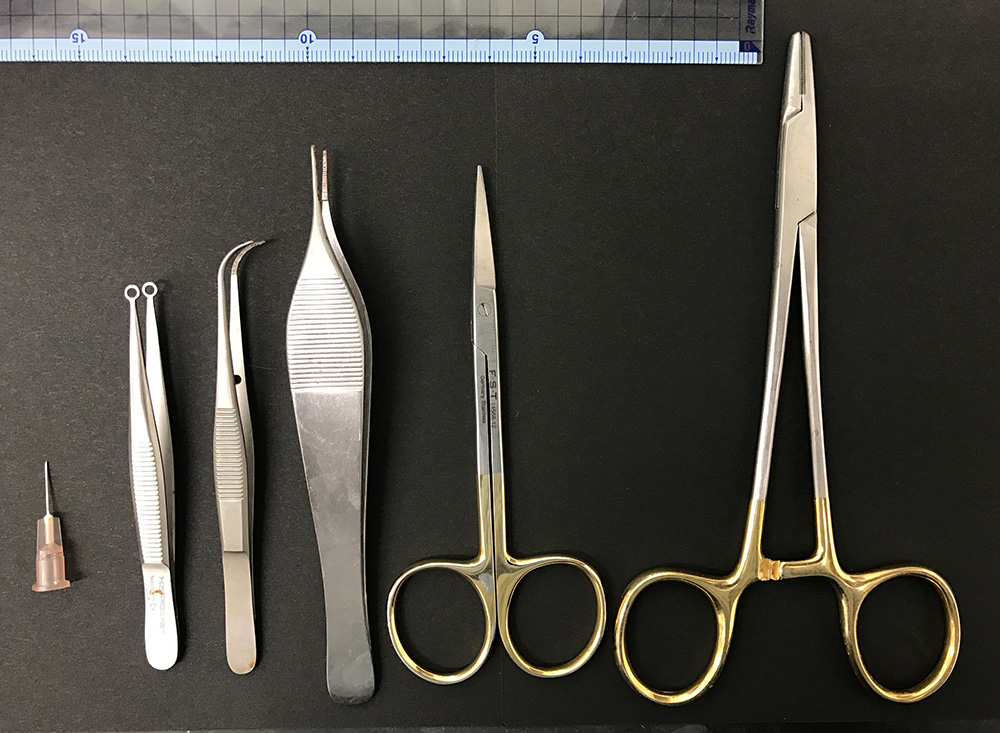
图 1.本协议中使用的手术器械
Procedure
A.为移植准备细胞
- 根据以往的研究(Takahashi和Yamanaka,2006;Takahashi等人,2007;Miyawaki等人,2016)培养iPSCs,确保细胞处于良好的生长状态。
- 需要准备至少2 x 10^6个细胞。
- 在解离前1小时更换新鲜培养基,以保证细胞活力。
- 用移液器吸掉旧的培养基,然后用PBS清洗细胞两次,去除残留的培养基和细胞碎片。
- 使用胰蛋白酶-EDTA(每10 cm培养皿1 ml)来分离细胞,胰蛋白酶能分解细胞间的粘连蛋白,使细胞分离。
- 用含有15%胎牛血清的培养基(对于小鼠iPSCs,见配方1)或胰蛋白酶抑制剂(对于NMR和人类iPSCs,见配方2)来停止胰蛋白酶的作用,防止过度分解细胞。
- 在15 ml锥形管中收集细胞,并用4 ml PBS重悬,准备进行下一步操作。
- 使用库尔特计数器准确计数细胞数量。
- 在室温下以200 x g的离心力离心细胞5分钟,去除上清液中的血清和酶。
- 吸掉上清液,然后用适量的PBS重悬iPSCs,调整细胞浓度至5 x 107细胞/ml,以便于注射。
- 将细胞转移到1.5 ml管中,准备注射。 将细胞放在冰上,保持低温,直到进行注射。
B. 小鼠注射过程 (可选)
为了预防手术感染,可以从手术前3天开始,直到手术后1周,给小鼠提供含有氨苄西林的饮水(1 g/L)。
将NOD/SCID小鼠放在加热垫上以保持体温,并用异氟醚进行麻醉,以确保手术过程中小鼠不会感到疼痛。
用70%乙醇清洁准备进行手术的区域,并剃除腹部毛发,以减少手术感染的风险。
在阴茎头包皮腺上方做长约1 cm的切口,然后打开小鼠的腹部,以便于进行手术。
小心地取出附睾脂肪垫连同睾丸(参见图2A),这是注射细胞的位置。
使用汉密尔顿注射器吸取20 µl含有1 x 106个细胞的悬液,准备进行注射。
用26号针头轻轻切开睾丸的白膜(参见图2B),为注射做好准备。
接着,使用汉密尔顿注射器将20 µl的细胞悬液注射入睾丸内(参见图2C)。
在注射完成后,缓慢移除针头,以防止细胞悬液倒流。 将睾丸放回小鼠体内原来的位置。
最后,缝合小鼠的伤口,完成手术。
注射过程的演示可以在视频 1 中观看。细胞悬液被蓝色染色以示范。
C. 评估多能性和致瘤性
在移植后4周、10周、20周或28周,按照实验室动物护理和使用指南的规定,对小鼠进行麻醉和安乐死。之后,对肿瘤和睾丸进行解剖学检查(参见图2D和2E)。
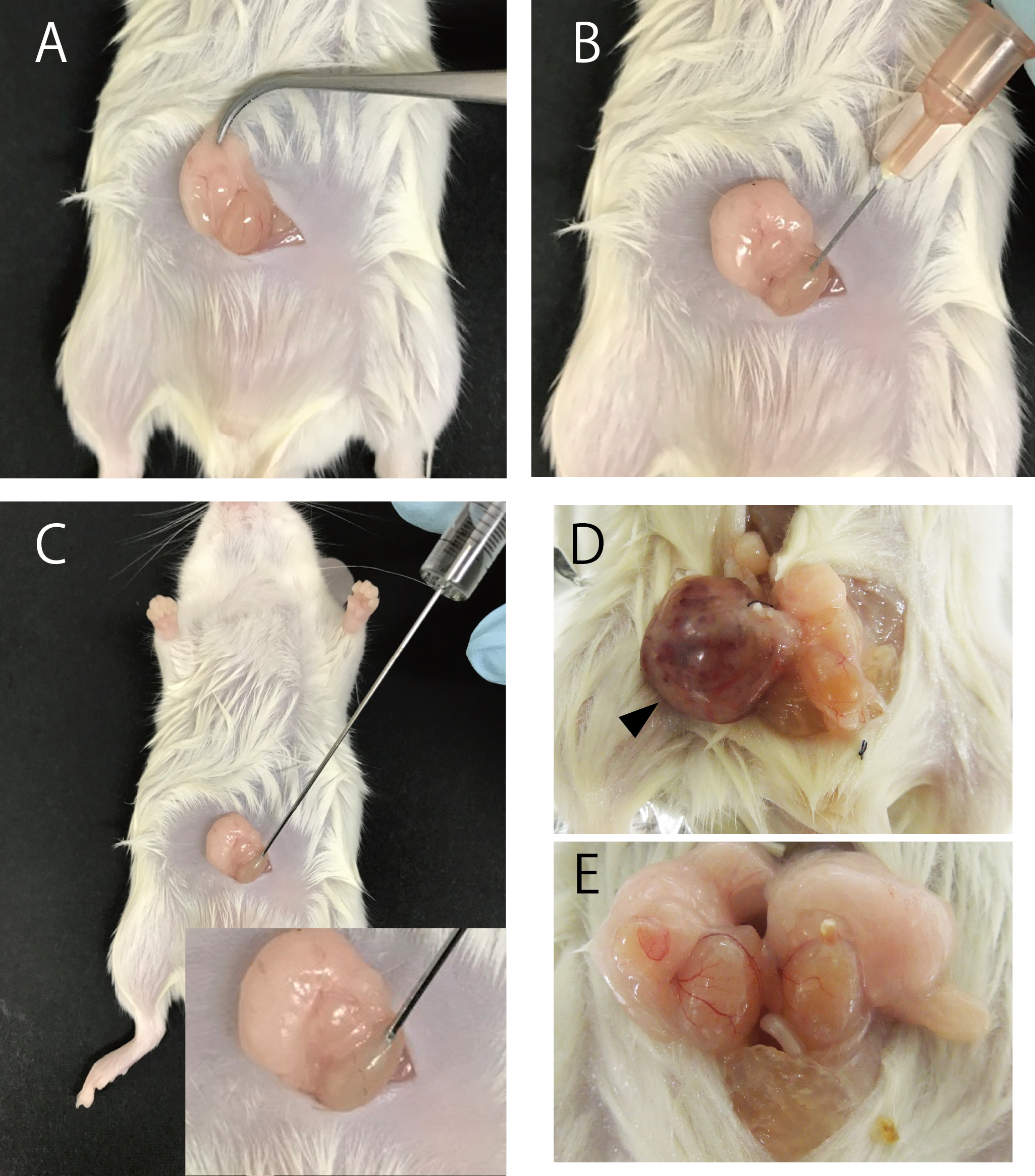
图2.将iPSC注射到NOD / SCID小鼠的睾丸中。移植程序 (A-C)。畸胎瘤 (D) 和睾丸无肿瘤形成 (E) 的代表性照片。箭头表示小鼠iPSC形成的畸胎瘤。
注意:注射小鼠iPSCs后4周和注射人类iPSCs后10周,可以观察到肿瘤的形成。进行这些检查的目的是为了评估移植的多能干细胞是否具有形成畸胎瘤的能力,以及这些细胞在体内生长和分化的情况。这些数据对于确定干细胞的多能性和它们在临床应用中的安全性至关重要。
在实验室用擦拭纸去除水分后,对肿瘤进行称重。 为了将肿瘤或睾丸组织进行石蜡包埋,需要在含4%多聚甲醛的PBS中固定过夜。
将切片进行苏木精和伊红(HE)染色,或者进行免疫组织化学分析,以检测绿色荧光蛋白(GFP)和分化标志物的表达情况。
研究人员之前的研究中展示了肿瘤和睾丸切片的示例,如图3所示(Miyawaki等人,2016)。
进行这些步骤的目的是为了观察和分析移植细胞在体内是否保持了多能性,以及是否分化成了不同的细胞类型。通过这些实验,研究人员可以评估多能干细胞在体内的行为和潜在的风险。
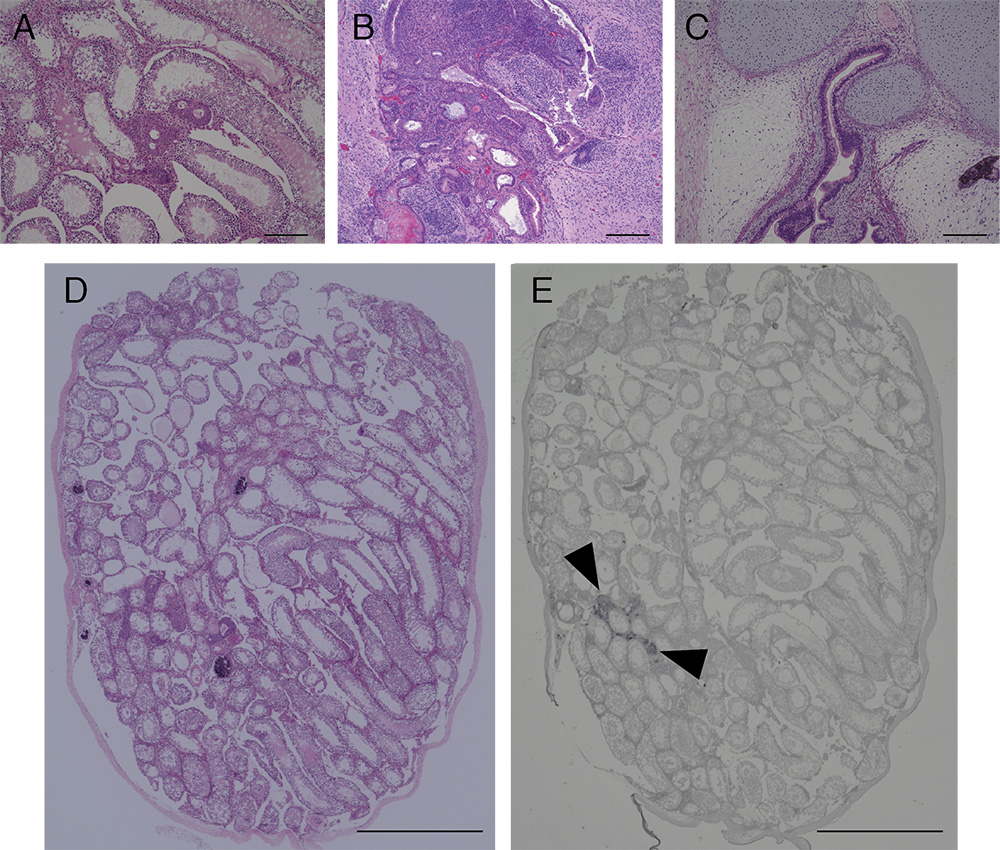
图3.iPSC 移植后肿瘤和睾丸的 HE 和免疫组织化学染色切片的图像。移植后 10 周(A 和 D)、移植后 4 周 (B) 或移植后 10 周人 iPSC (C) 移植的小鼠 NMR iPSC 的肿瘤和睾丸的 HE 染色切片。GFP (E) 的免疫组织化学分析。箭头表示移植的GFP标记的NMR iPSC。比例尺,200μm(A-C)和1cm(D和E)。
Data analysis
在实验中,对肿瘤或睾丸的重量数据进行对数转换(转换公式为任意单位:6 + log2)后,进行了分析。使用Bartlett检验来确定不同样本组之间的方差是否一致。实验组间的差异是否具有统计学意义,是通过单因素方差分析或Kruskal-Wallis检验来确定的,随后使用Dunn方法进行校正,这个过程都是通过GraphPad Prism 6软件完成的。当P值小于0.05时,研究人员认为这种差异是统计学上显著的。所有的数据结果都是用平均值 ± 标准误差(SEM)来表示的,正如Miyawaki等人,2016年的研究中展示的那样。
研究人员先前研究中肿瘤和睾丸的重量显示在表1中以供参考(Miyawaki等人,2016)。
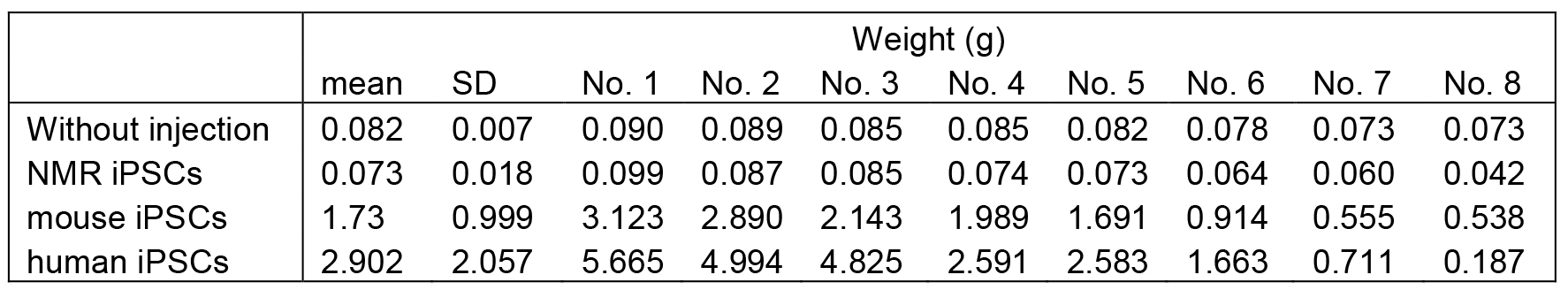
Note: 对数转换是一种数学方法,用于将数据转换成对数形式,这有助于在数据分布不均或偏斜时,使数据更加符合正态分布,从而使统计分析更加准确。Bartlett检验用于评估不同样本组之间方差是否相等,这对于后续的方差分析至关重要。单因素方差分析(ANOVA)和Kruskal-Wallis检验是两种常用的统计方法,用于比较两个或多个实验组之间的平均值是否存在显著差异。Dunn方法是一种用于校正ANOVA或Kruskal-Wallis检验结果的方法,以减少假阳性结果的可能性。P值是统计学中用来表示结果发生随机误差的可能性,P < 0.05通常被认为是统计学上显著的差异。标准误差(SEM)是衡量数据集中单个观测值与平均值之间差异的标准差,它提供了数据的精确度。
Recipes
小鼠诱导多能干细胞(iPSCs)培养基
杜氏改良伊格尔培养基(Dulbecco, Sigma-Aldrich):一种广泛使用的细胞培养基,含有多种必需的营养成分。
15%胎牛血清(JRH或BioWest):提供细胞生长所需的营养和生长因子。
1%青霉素/链霉素(Wako Pure Chemical Industries):用于防止细胞培养中的细菌污染。
2 mM L-谷氨酰胺(NACALAI TESQUE):是细胞代谢过程中必需的氨基酸之一。
0.1 mM非必需氨基酸(NACALAI TESQUE):虽然不是细胞生存的必需品,但可以提供额外的营养。
0.1 mM β-巯基乙醇(Sigma-Aldrich):作为抗氧化剂,有助于保持细胞活力。
人重组白血病抑制因子(NACALAI TESQUE):是一种重要的生长因子,对维持多能干细胞的未分化状态至关重要。
通过0.22微米过滤器过滤:确保培养基的纯净度。
储存于4°C:保持培养基的新鲜度和活性。裸鼹鼠和人诱导多能干细胞(iPSCs)培养基
DMEM/F12(Sigma-Aldrich):一种常用的细胞培养基,适用于多种细胞类型。
20% KnockOut血清替代品(Thermo Fisher Scientific):提供细胞生长所需的类似血清的支持,减少依赖动物血清的需求。
1% 青霉素/链霉素(Wako Pure Chemical Industries):用于防止细胞培养中的细菌污染。
2 mM L-谷氨酰胺(NACALAI TESQUE):是细胞代谢过程中必需的氨基酸之一。
0.1 mM 非必需氨基酸(NACALAI TESQUE):虽然不是细胞生存的必需品,但可以提供额外的营养。
0.1 mM β-巯基乙醇(Sigma-Aldrich):作为抗氧化剂,有助于保持细胞活力。
4 ng/ml 成纤维细胞生长因子2(PeproTech):一种重要的生长因子,对维持多能干细胞的未分化状态和促进其增殖至关重要。
通过0.22微米过滤器过滤:确保培养基的纯净度。
储存于4°C:保持培养基的新鲜度和活性。4% 多聚甲醛(PFA)
称取4克PFA , 准备100毫升PBS(磷酸盐缓冲液), 在加热搅拌器上加热溶液 ,向溶液中加入20微升 1 M的氢氧化钠溶液, 以溶解剩余的PFA , 将溶液分装并存放在-20°C的冰箱中保存 。
注意:在制备PFA的过程中,研究人员必须佩戴面罩、手套、实验服和护目镜,以保护自己免受化学物质的伤害。
References
- Cheng, C. Y. and Mruk, D. D. (2012). The blood-testis barrier and its implications for male contraception. Pharmacol Rev 64(1): 16-64.
- Evans, M. J. and Kaufman, M. H. (1981). Establishment in culture of pluripotential cells from mouse embryos. Nature 292(5819): 154-156.
- Gropp, M., Shilo, V., Vainer, G., Gov, M., Gil, Y., Khaner, H., Matzrafi, L., Idelson, M., Kopolovic, J., Zak, N. B. and Reubinoff, B. E. (2012). Standardization of the teratoma assay for analysis of pluripotency of human ES cells and biosafety of their differentiated progeny. PLoS One 7(9): e45532.
- Hentze, H., Soong, P. L., Wang, S. T., Phillips, B. W., Putti, T. C. and Dunn, N. R. (2009). Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies. Stem Cell Res 2(3): 198-210.
- Itakura, G., Kawabata, S., Ando, M., Nishiyama, Y., Sugai, K., Ozaki, M., Iida, T., Ookubo, T., Kojima, K., Kashiwagi, R., Yasutake, K., Nakauchi, H., Miyoshi, H., Nagoshi, N., Kohyama, J., Iwanami, A., Matsumoto, M., Nakamura, M. and Okano, H. (2017). Fail-safe system against potential tumorigenicity after transplantation of iPSC derivatives. Stem Cell Reports 8(3): 673-684.
- Miura, K., Okada, Y., Aoi, T., Okada, A., Takahashi, K., Okita, K., Nakagawa, M., Koyanagi, M., Tanabe, K., Ohnuki, M., Ogawa, D., Ikeda, E., Okano, H. and Yamanaka, S. (2009). Variation in the safety of induced pluripotent stem cell lines. Nat Biotechnol 27(8): 743-745.
- Miyawaki, S., Kawamura, Y., Oiwa, Y., Shimizu, A., Hachiya, T., Bono, H., Koya, I., Okada, Y., Kimura, T., Tsuchiya, Y., Suzuki, S., Onishi, N., Kuzumaki, N., Matsuzaki, Y., Narita, M., Ikeda, E., Okanoya, K., Seino, K., Saya, H., Okano, H. and Miura, K. (2016). Tumour resistance in induced pluripotent stem cells derived from naked mole-rats. Nat Commun 7: 11471.
- Okano, H., Nakamura, M., Yoshida, K., Okada, Y., Tsuji, O., Nori, S., Ikeda, E., Yamanaka, S. and Miura, K. (2013). Steps toward safe cell therapy using induced pluripotent stem cells. Circ Res 112(3): 523-533.
- Okita, K., Ichisaka, T. and Yamanaka, S. (2007). Generation of germline-competent induced pluripotent stem cells. Nature 448(7151): 313-317.
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K. and Yamanaka, S. (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131(5): 861-872.
- Takahashi, K. and Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126(4): 663-676.
- Vazquez-Martin, A., Cufi, S., Lopez-Bonet, E., Corominas-Faja, B., Oliveras-Ferraros, C., Martin-Castillo, B. and Menendez, J. A. (2012). Metformin limits the tumourigenicity of iPS cells without affecting their pluripotency. Sci Rep 2: 964.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/08/采用畸胎瘤形成分析法评估多能干细胞的多能性和致瘤性/
- 版权声明: 转载请注明出处,谢谢。

