Published: April 12, 2021 doi: 10.3791/62456
Summary
本文描述了诱导多能干细胞与含有近端和远端上皮肺细胞以及间充质的三维全肺类器官的逐步定向分化。
Abstract
由于缺乏生物学相关的 体外 模型系统,人类肺部发育和疾病一直难以研究。人类诱导多能干细胞(hiPSCs)可以逐步分化成3D多细胞肺类器官,由上皮细胞群和间充质细胞群组成。我们通过暂时引入各种生长因子和小分子来概括胚胎发育线索,以有效地产生明确的内胚层,前颈内胚层,以及随后的肺祖细胞。然后将这些细胞嵌入生长因子减少(GFR)基底膜基质培养基中,使它们能够响应外部生长因子自发发育成3D肺类器官。这些全肺类器官(WLO)在暴露于地塞米松,环AMP和异丁基黄嘌呤后经历早期肺部发育阶段,包括分支形态发生和成熟。WLO具有表达标志物KRT5(基底),SCGB3A2(俱乐部)和MUC5AC(杯)的气道上皮细胞以及表达HOPX(肺泡I型)和SP-C(肺泡II型)的肺泡上皮细胞。还存在间充质细胞,包括平滑肌肌动蛋白(SMA)和血小板衍生的生长因子受体A(PDGFRα)。iPSC衍生的WLO可以在3D培养条件下维持数月,并且可以分类为表面标记物以纯化特定的细胞群。iPSC衍生的WLO也可用于研究人肺发育,包括肺上皮和间充质之间的信号传导,模拟人肺细胞功能和发育的基因突变,并确定感染因子的细胞毒性。
Introduction
肺是一个复杂的、异质的、动态的器官,在六个不同的阶段发育 - 胚胎期、假性腺体、小管性、囊状、肺泡和微血管成熟[1,2]。后两个阶段发生在人类发育的前后阶段,而前四个阶段只发生在胎儿发育过程中,除非发生早产[3]。胚胎期从内胚层开始,以气管和肺芽的萌芽结束。肺部发育部分通过上皮细胞和间充质细胞之间的信号传导发生[4]。这些相互作用导致肺分支,增殖,细胞命运决定和发育中肺的细胞分化。肺分为传导区(气管到末端细支气管)和呼吸区(呼吸道细支气管到肺泡)。每个区域包含独特的上皮细胞类型: 包括传导气道中的基底细胞、分泌细胞、纤毛细胞、刷状细胞、神经内分泌细胞和离子细胞[5],其次是呼吸道上皮中的肺泡 I 型和 II 型细胞[6]。关于各种细胞类型的发育和对损伤的反应,还有很多未知数。iPSC衍生的肺类器官模型能够研究驱动人类肺部发育的机制,基因突变对肺功能的影响,以及上皮和间充质对感染因子的反应,而无需原发性人体肺组织。
与胚胎分化各个阶段相对应的标志物包括用于确定性内胚层 (DE)[7] 的 CXCR4、cKit、FOXA2 和 SOX17、用于前肠内胚层前端(AFE)[8] 的 FOXA2、TBX1 和 SOX2,以及用于早期肺祖细胞的 NKX2-1[9]。在胚胎肺发育中,前肠分为背食道和腹侧气管。右肺和左肺的芽表现为气管芽周围的两个独立的外垂[10]。在分支形态发生过程中,上皮周围的间充质产生弹性组织、平滑肌、软骨和脉管系统11。上皮和间充质之间的相互作用对于正常的肺部发育至关重要。这包括间充质分泌的FGF10[12]和上皮产生的SHH[13]。
在这里,我们描述了一种将hiPSCs定向分化为三维(3D)全肺类器官(WLO)的方案。虽然有类似的方法通过LPC阶段的分选分离肺祖细胞,以制造肺泡样[14,15] (远端)类器官或气道[16] (近端)类器官,或产生腹侧前肠球状体,使人肺类器官表达肺泡细胞和间充质标志物以及芽尖祖器官[17],这种方法的优势在于包括肺上皮细胞和间充质细胞类型,以在 体外模式和协调肺分支形态发生,成熟和扩增。
该协议使用小分子和生长因子来指导多能干细胞通过确定性内胚层,前叶内胚层和肺祖细胞的分化。然后,这些细胞通过重要的发育步骤(包括分支和成熟)被诱导成3D全肺类器官。分化方案的摘要如图 1a 所示,内胚层和类器官分化的代表性明场图像如图 1b所示。 图1c -d 显示了完成分化后内胚层分化的基因表达细节以及肺上皮细胞近端和远端群体的基因表达。
Protocol
该研究方案由UCSD人类研究保护计划机构审查委员会批准(181180)。
1. 诱导多能干细胞的确定性内胚层诱导(第1-3天)
- 使用前30分钟在冰上缓慢解冻生长因子减少(GFR)基底膜(BM)基质培养基。在冷的DMEM/F12混合物中,以1∶1的比例稀释GFR BM基质培养基,使其构成该培养基的50%。使用前将 P1000 移液器吸头放入冰箱中冷藏。
- 用在冰冷的DMEM / F12中制备的500μL50%GFR基底膜基质培养基体涂覆12孔板的每个孔。一旦涂覆了所需数量的孔,从孔中除去任何多余的介质混合物和/或气泡,并将板放在4°C的冰或冰箱上20分钟以凝固。然后,将板移至37°C的培养箱过夜以凝胶并干燥。
- 一旦hiPSCs达到70-90%汇合度,在解离前一小时加入10μMRho相关激酶(ROCK)抑制剂Y-27632。吸出培养基,用磷酸盐缓冲盐水(PBS)洗涤一次。通过加入细胞分离培养基(0.5 mL /孔的12孔板)解离hiPSCs,并在5%CO 2培养箱中在37°C下孵育20 分钟。
- 从培养箱中取出板,将0.5mL / 12孔的干细胞传代培养基(表1)加入孔中;使用P1000尖端轻轻研磨细胞以获得单细胞悬浮液。将解离的细胞转移到15mL锥形离心管中;在300× g下离心5分钟。
- 吸出培养基并用1mL mTeSR Plus培养基重悬细胞沉淀,并补充10μM ROCK抑制剂(Y-27632)。执行细胞计数。在1 mL mTeSR中加入2.0 x 105 hiPSCs,每孔12孔GFR基底膜介质包衣板中补充ROCK抑制剂Y-27632。在37°C孵育过夜。
注意:必须为每个细胞系优化细胞接种数量。种植培养24小时后,孔应汇合50%-70%。 - 在第1天,吸出mTeSR Plus并加入确定性内胚层(DE)诱导培养基(表1),并补充100ng / mL人激活素A和5μMGSK3β抑制剂/ Wnt激活剂CHIR99021。
注意:具有GSK3β抑制剂/ Wnt激活剂CHIR99021的DE培养基应在DE诱导第1天的20-24小时内取出,以成功分化。 - 在第 2 天和第 3 天,换用仅补充 100 ng/mL 的激活素 A 的 DE 诱导培养基。
注意:DE分化不应超过72小时,否则疗效会降低。在第4天,如果观察到大细胞死亡,则将总DE培养基暴露时间减少6-12小时。 - 为了分析DE效率,通过流式细胞术或FOXA2和/或SOX17的免疫荧光分析确认大于90%的CXCR4和/或cKit表达(图2a)。
2. 前肠前内胚层 (AFE) 诱导 (第 4 - 6 天)
- 在第4天,将培养基换成血清游离基础培养基(SFBM)(表1),补充10μM SB431542和2μM背吗啡用于AFE诱导。每天更换AFE介质3天(第4天,第5天和第6天)。
- 为了分析AFE效率,通过免疫荧光染色确认SOX2,TBX1和FOXA2的稳健表达(图2b)。
3. 肺祖细胞(LPC)分化(第7-16天)
- 第7天,在冰上解冻GFR基底膜基质培养基。吸出AFE培养基,用1x PBS清洗干净。加入1mL细胞分离溶液,并在37°C下孵育10分钟。
- 将1mL淬火培养基(DMEM / F12中的2%FBS)加入含有细胞分离溶液的孔中。通过轻轻上下移液将细胞保持为聚集体。确保所有细胞被移位并转移到15mL锥形离心管中。在300× g下离心5分钟。
- 除去上清液并将细胞沉淀重悬于补充有10ng / mL人重组骨形态蛋白-4(BMP4),0.1μM全反式视黄酸(RA),3μMGSK3β抑制剂/ Wnt激活剂CHIR99021和10μM岩石抑制剂Y-27632的淬火培养基中。
- 执行细胞计数。将2.5×105 个细胞加入100μL冷GFR基底膜基质培养基中,充分混合,并将液滴放入12孔板的孔中。将板在37°C下孵育30-60分钟,以使培养基聚合。每孔加入1 mL LPC培养基,并补充10μM的ROCK抑制剂Y-27632,确保培养基滴完全浸没并在37°C下孵育过夜。
- 在LPC诱导后第8天24小时,更换LPC培养基以除去ROCK抑制剂Y-27632。每隔一天更换一次 LPC 介质,总共 9-11 天。
注意:如果培养基在24小时内变黄,请每天更换培养基。 - 为了分析LPC效率,确认细胞内转录因子NKX2-1的稳健表达或对表面标志物CD47hi / CD26low15或CPM18进行流式细胞术(图2c)。总的来说,LPC球体应该是圆形和透明的(图2c)。
注意:如果NKX2-1的效率低于30%,则不要进行肺类器官分化。
4. 3D肺类器官诱导(第16-22天)
- 在第17天,在冰上解冻GFR基底膜基质介质。吸出LPC诱导培养基。然后向孔中加入2μg/ mL的分散酶(1mL),并用P1000移液器重悬培养基/分离酶混合物。在37°C孵育15分钟。再次研磨混合物并在37°C下再孵育15分钟。
- 将分散酶和细胞转移到15mL锥形离心管中。使用冷却的PBS(2-3 mL)洗涤孔并重悬分散酶/细胞混合物。在400× g下离心5分钟。手动除去上清液,注意不要对培养基/细胞沉淀层进行消毒。重复冷却的PBS洗涤,并在400× g下离心锥形离心管再离心5分钟。
- 手动除去上清液,然后将2mL胰蛋白酶基解离溶液加入锥形离心管中。在37°C孵育12分钟。
- 孵育后,用P1000移液器吸头重悬细胞。然后将等体积的淬火介质加入锥形离心管中,并以400× g 向下旋转5分钟。吸出上清液并将细胞重悬于淬灭培养基+ 10μM的ROCK抑制剂Y-27632中。
注意:当细胞作为聚集体而不是单个细胞嵌入时,会发生成功的肺类器官诱导,相应地调整移液。 - 执行细胞计数。计算获得每孔5.0-8.0 x 104 个细胞所需的体积。将LPC细胞等分到1.5mL微量离心管中,并在400× g下离心5分钟。除去多余的上清液,注意不要搅动细胞沉淀。仅留下10μL残留培养基。
- 将细胞沉淀重新悬浮在200μL冷GFR基底膜基质培养基质培养基中,并加入细胞培养膜插入物(直径6.5mm,0.4μm孔,聚酯膜)。将板在37°C孵育30-60分钟,以使GFR基底膜基质介质聚合。
- 将1mL补充成纤维细胞生长因子-7(FGF7)(10ng / mL),FGF10(10ng / mL),GSK3β抑制剂/ Wnt激活剂CHIR(3μM),表皮生长因子(EGF)(10ng / mL)和10μMROCK抑制剂Y-27632的3D类器官诱导培养基(表1)加入膜插入物的基底外侧腔。每隔一天更换一次培养基,持续 6 天。
5. 3D 肺类器官分支(第23-28天)
- 在第23天,换用补充FGF7(10 ng / mL),FGF10(10ng / mL),GSK3β抑制剂/ Wnt激活剂CHIR99021(3μM),RA(0.1μM),EGF(10ng / mL)和血管内皮生长因子(VEGF)/胎盘生长因子(PlGF)(10ng / mL)的3D支化培养基(表1)。每隔一天更换一次培养基,持续 6 天。
注意:在3D分支分化的第6天,应该有多个分支类器官(图2)。
6.3D肺类器官成熟 (第29- 34天)
- 在第29天,换用3D成熟培养基(表1),其与3D支化培养基相同,但加入地塞米松(50nM),cAMP(100μM)和3-异丁基-1-甲基黄嘌呤(IBMX),磷酸二酯酶抑制剂也称为异丁基黄嘌呤(100μM)。每隔一天更换一次培养基,持续 6 天。
注意:在3D成熟后24小时内,分支类器官应膨胀并变成透明球体。
7.3D 肺类器官免疫细胞化学
- 对于3D全肺类器官分析,在4°C下将GFR基底膜基质基质培养基固定在具有4%多聚甲醛(PFA)的膜插入物中1小时。 嵌入石蜡中,并按照标准公布的协议安装到载玻片上。
- 染色前进行抗原检索。气道标志物包括 KRT5、MUC5AC 和 SCGB3A2。肺泡标志物包括SP-C,SP-B,HTII-280,HTI-56和HOPX(图3)。
8. 从 GFR 基底膜基质培养基中取出全肺类器官,用于传代、FACS 或冷冻保存
- 要从GFR基底膜基质培养基中解离类器官,请从基底腔中除去培养基,并在顶室中加入2μg/ mL的分散酶(1 mL)。
- 用P1000移液器轻轻研磨培养基/分离酶混合物,并置于培养箱中15分钟。再次轻轻研磨混合物,再孵育15分钟。
- 加入1mL冷却的PBS(4°C),并将含有基质培养基的类器官转移到15mL锥形离心管中。以400 x g 旋转5分钟。小心除去上清液,不要干扰细胞沉淀。
- 用 1 mL 冷藏的 PBS 再次洗涤,然后以 400 x g 离心 5 分钟。小心取出上清液,不要干扰培养基/细胞混合物。
- 将1mL细胞分离溶液加入锥形离心管中,轻轻研磨重悬GFR-基底膜基质培养基质/细胞混合物。置于培养箱中12分钟,将细胞作为聚集体传代或用于冷冻保存),或20分钟用于单细胞悬浮液。
- 加入等体积的淬火培养基,以400 x g 离心5分钟。重悬于淬火培养基+ 10μM的ROCK抑制剂Y-27632中。
注意:在此步骤中,不应在管中看到残留的基底膜介质。如果残留培养基,请重复步骤8.5和8.6。 - 执行细胞计数。计算下游应用所需的体积。
Representative Results
培养种植后24小时,第1天,iPSCs应为50%-90%汇合。在第 2 天,DE 应为 90%-95% 汇合。在DE诱导期间,通常在第4天观察到显着的细胞死亡,但附着的细胞将保留紧凑的鹅卵石形态(图2b)。如果大多数贴壁细胞分离,则停止分化,并考虑将活性素A的DE培养基暴露时间缩短6-12小时。在AFE诱导期间,细胞死亡是最小的,细胞保持贴壁,但会显得更小,更异质。
只有当双阳性SOX2和FOXA2的产量>80%时,才能在第7天传代细胞。在传代到基底膜基质中进行3D LPC诱导后,小球体将首先出现,然后生长,有些可能开始分支。成功进行内胚层分化的基因表达谱包括 DE 处的 SOX17 增加,FOXA2 和 SOX2 增加,SOX17 减少,NKX2-1 首次出现,NKX2-1 增加,以及 SOX2 和 FOXA2 的存在。
与早期胚胎发育一致,AFE的腹腔化发生在肺芽发育(NKX2-1 +)和AFE的背侧化发生在胃肠道发育(SOX2 +)。LPC的培养物将混合肺和胃祖。
LPC的肺类器官诱导已使用各种方法进行。一些小组使用NKX2-1荧光报告基因或表面抗原代理(CPM,CD26lowCD47high)对细胞进行分类。但这些肺类器官含有肺泡II型细胞,如没有肺泡I型细胞或间充质的细胞。
其他小组已经收集了从AFE / LPC单层中萌芽的细胞团块,并将其嵌入基底膜基质中。这些类器官含有肺上皮细胞和间充质细胞的混合群体,但培养需要数月[19]。我们的方案包括上皮细胞和间充质细胞的存在。WLO表达近端上皮细胞标志物p63和KRT5(基底细胞)和SCGB3A2(俱乐部细胞)以及远端上皮细胞标志物HOPX(ATI)和proSPC,SPB和NKX2-1(ATII)。他们还在LPC阶段以及整个肺类器官中表达间充质标志物Vimentin。PDGFRα是成纤维细胞的标志物,在排尿和肺泡化过程中在肺部具有重要功能20,并与远端细胞分化中重要的转录因子SOX9共表达(图3)。
我们的方法使用胎儿肺发育中发生的信号分子有效地生成表达NKX2-1的LPC 3D培养物,以形成早期肺类器官。当将LPC传导到GFR基底膜基质培养基中以诱导肺类器官时,必须不要过度解离成单个细胞悬浮液,而是保留小团块细胞(10个细胞/团)。细胞计数将不完全准确,但仍然需要避免在3周肺类器官分化期间过度汇合。
肺类器官诱导应在诱导的第 6 天(分化的第 23 天)产生小的分支类器官。这些应该在类器官分支步骤和成熟步骤中继续生长。在引入地塞米松,cAMP和IBMX二十四小时后,分支应该扩展到透明球体。可以在分化结束时进行全肺类器官分析,或者WLO可以通过GFR进入新鲜的基底膜基质,或者通过冷冻在10%DMSO中冷冻保存。
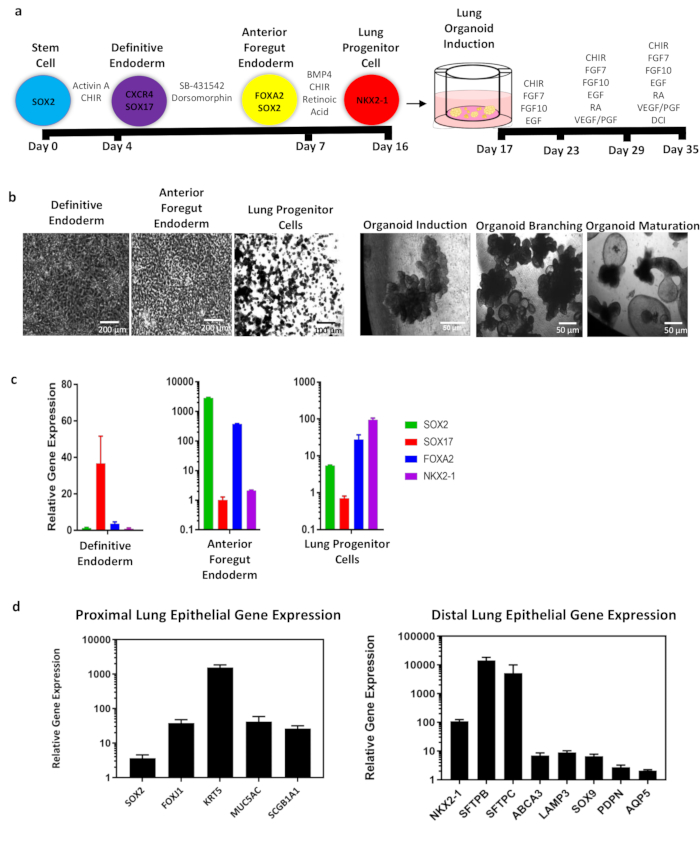
图1:全肺类器官(WLO)与hiPSCs的分化总体示意图和代表性数据。圆圈表示具有识别标记的内胚层细胞类型。分化的时间线以黑条表示。生长因子和/或小分子用于诱导内胚层和肺类器官群体。总之,干细胞在大约16天内分化成明确的内胚层,前肠前胚层内胚层和肺祖细胞。然后将这些细胞传入含有培养基插入物的GFR基底膜基质培养基中,并进行肺类器官诱导,分支和成熟。总分化大约需要35天。(b)主要内胚层细胞的代表性相差图像和整个肺类器官的3D图像。面板中指示的比例尺大小。(c)内胚层期间肺部发育标志物的qRT-PCR分析,以及 (d) 近端和远端细胞标志物的全肺类器官分化。所有数据平均代表3-5个生物重复。误差线表示均值的标准误差,并归一化为肌动蛋白。请点击此处查看此图的放大版本。
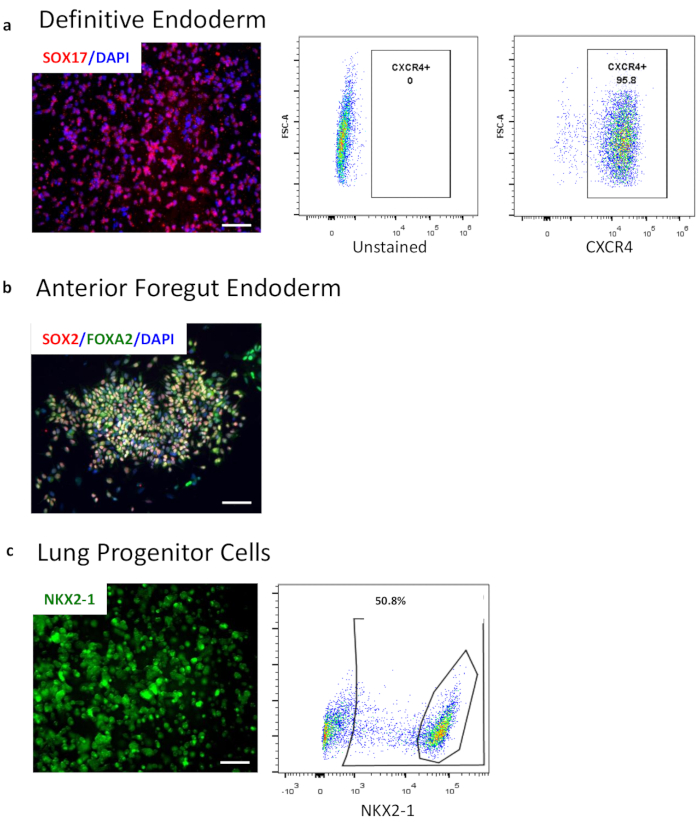
图2:通过流式细胞术和免疫细胞化学表征内胚层分化。 (a)确定性内胚层标志物CXCR4的流式细胞术。左面板显示针对未染色人群的门控,而中间面板显示 CXCR4 阳性人群。右图显示了覆盖有细胞核(蓝色)的 SOX17(红色)的免疫细胞化学图像。(b)AFE标志物FOXA2和SOX2覆盖细胞核(蓝色)的免疫细胞化学图像。(c)NKX2-1-GFP在3D LPC报告细胞系中的内源性表达。从明场和GFP的活细胞培养物中拍摄的图像。固定和透化后肺祖细胞内标志物NKX2-1的流式细胞术。比例尺尺寸 = 50 μM。 请单击此处查看此图的放大版本。
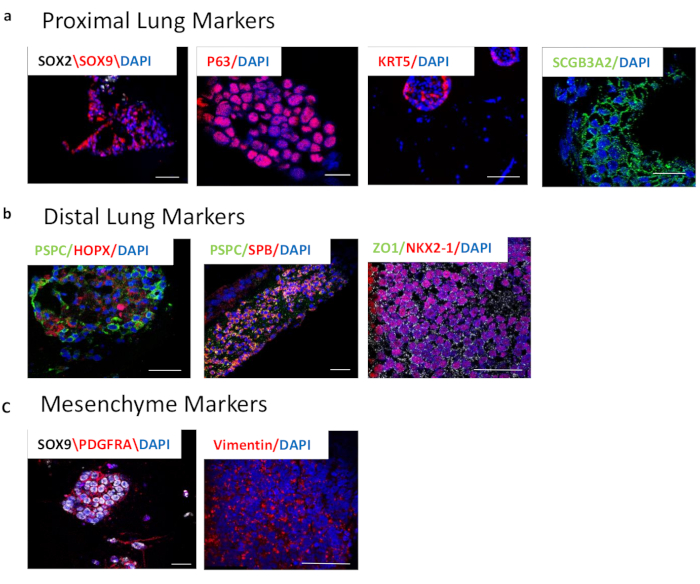
图3:通过免疫细胞化学分化3周后3D全肺类器官的表征。左面板显示由原子核(蓝色)覆盖的 SOX2(白色)和 SOX9(红色)。这些标志物在分支形态发生中很重要,代表近端和远端上皮群体。中间的面板显示P63(红色)和KRT5(红色),两者都是基底细胞的标志物。右图显示了SCGB3A2,这是俱乐部细胞的标志物。(b) 远端肺标志物。左图分别描绘了亲SPC(PSPC),(绿色)和HOPX(红色),肺泡II型ad I细胞的标志物,覆盖着细胞核(蓝色)。中间图显示了前SPC(PSPC)(绿色)和SPB(红色),肺泡II型细胞的标志物,覆盖着细胞核(蓝色)。右侧面板显示 NKX2-1(红色)和 ZO1(绿色)覆盖着原子核(蓝色)。 (c) 肺间充质标志物。左图显示 PDGFRA(红色)和 SOX9(白色),代表远端间充质。右图显示Vimentin(红色),它分散在整个肺部。比例尺尺寸 = 50 μM。请单击此处查看此图的放大版本。
| 试剂和解决方案 - 有关公司名称,请参阅材料列表 |
|---|
| 3D类器官诱导培养基(第17-22天) |
| 无血清基础培养基(见食谱),辅以: |
| FGF7 (10 纳克/毫升) |
| FGF10 (10 纳克/毫升) |
| CHIR99021 (3 μM) |
| EGF (10 纳克/毫升) |
| 3D类器官分支培养基(第23-28天) |
| 无血清基础培养基(见食谱),辅以: |
| FGF7 (10 纳克/毫升) |
| FGF10 (10 纳克/毫升) |
| CHIR99021 (3 μM) |
| 全反式视黄酸 (0.1 μM) |
| EGF (10 纳克/毫升) |
| 素食/猪瘟 (10 纳克/毫升) |
| 3D类器官成熟培养基(第29-34天) |
| 无血清基础培养基(见食谱),辅以: |
| 地塞米松 (50 nM) |
| 溴-cAMP (100 μM) |
| IBMX (100 μM) |
| AFE 诱导培养基(第 4-6 天) |
| 无血清基础培养基(见食谱),辅以: |
| SB431542 (10 μM) |
| 背吗啡(2μM) |
| DE 感应培养基(第 1-3 天) |
| 48.5 mL RPMI1640 + 谷氨酰胺 |
| 1 mL B27,不含视黄酸 |
| 500μl肝素(1%) |
| 500 μl 笔/链球菌 |
| 人激活素A(100纳克/毫升) |
| CHIR99021 (5 μM) - 仅在前 24 小时内 |
| LPC诱导培养基(第7-16天) |
| 无血清基础培养基(见食谱),辅以: |
| BMP4 (10 纳克/毫升) |
| 全反式视黄酸 (RA) (0.1 μM) |
| CHIR99021 (3 μM) |
| 淬火介质 |
| 49 毫升 DMEM/F12 |
| 1 毫升前端总线 |
| 无血清基础培养基 (SFBM) |
| 375 mL 伊斯科夫改良杜尔贝克培养基 (IMDM) + 谷氨酰胺 |
| 125 毫升火腿 F12 |
| 5 mL B27,不含视黄酸 |
| 2.5 毫升氮气 |
| 500μl抗坏血酸,50毫克/毫升 |
| 13μl单硫甘油/ 1ml IMDM”每100ml血清游离培养基使用300ul 0.4mM单硫甘油 |
| 3.75 mL 牛血清白蛋白 (BSA) V 级分,7.5% 溶液 |
| 500 μl 笔/链球菌 |
| 干细胞传代培养基(第0天) |
| 500 毫升 DMEM/F12 |
| 129 mL 去核血清替代疗法 (KSR) |
| 6.5 mL 谷氨酰胺 |
| 6.5 毫升新酸氮杂环 |
| 1.3毫升2-巯基乙醇 |
| 6.5 mL 支链球菌 |
表1:介质表。
| 问题 | 溶液 |
|---|---|
| DE 分化效率不高 | 在干细胞培养基中接种24小时后,细胞应融合50-70% |
| GSK3β 抑制剂/Wnt 激活剂 CHIR99021 应在第 1 天 DE 诱导后 20-24 小时内取出 | |
| DE 分化不应超过 72 小时 | |
| AFE 分化效率不高 | 确保DE分化成功,细胞表达>80%CXCR4 |
| 确保每天将新鲜的生长因子/小分子添加到培养基中 | |
| LPC 分化效率不高 | 确保AFE分化成功,细胞表达>80%FOXA2 / SOX2 |
| 确保AFE细胞以4-10个细胞的聚集体而不是单细胞的形式传代 | |
| 3D肺类器官不生长或分化 | 确保LPC差异化成功,并且细胞表达>30%NKX2-1 |
| 确保LPC以4-10个细胞的聚集体而不是单细胞递送 | |
| 确保在传代过程中没有来自LPC的残留基质胶 | |
| 每次更换介质时添加岩石抑制剂 Y-27632 | |
| 确保按时更换培养基并添加新鲜的生长因子/小分子 | |
| 确保生长因子/小分子的浓度正确 |
表 2:故障排除。
Discussion
3D全肺类器官(WLO)的成功分化依赖于多步骤,6周的方案,并注重细节,包括暴露于生长因子和小分子的时间,传代后的细胞密度以及hiPSCs的质量。故障排除请参见 表2。hiPSCs 应约为 70%-80% 汇合,解离前自发分化小于 5%。该协议要求”mTeSR+”介质;然而,普通的”mTeSR”培养基也被使用,结果相当,而且价格更便宜。对于细胞外基质,我们使用GFR基底膜基质培养基质。我们使用ReLesR(见 材料表)通过hiPSC以减少差异化。
在内胚层分化过程中,应每天在培养基更换之前和之后观察细胞。指定的生长因子/小分子应每天新鲜加入基础培养基中,以防止过早降解。确定性内胚层 (DE) 中的细胞死亡很常见,但在前牙前内胚层 (AFE) 和肺祖细胞 (LPC) 诱导期间应受到限制。如果在DE的第三天(第4天)出现大的死亡,则将DE的总时间减少6-12小时。新的iPSC细胞系可能需要进行优化,以成功进行内胚层分化。在DE处对CXCR4进行流式细胞术以确认成功诱导(>85%CXCR4 +细胞)。细胞在AFE时应该相对稳定,并且形态变化很少。
传代到LPC是另一个必须针对细胞类型进行优化的过程。以过低的密度(<50%)重镀细胞将导致分化效率低下。通过免疫细胞化学法确认 LPC 诱导 NKX2-1 或流式细胞术对 CPM18 或 CD26low/CD47high15 的成功诱导。成功的LPC诱导必须具有>40%的NKX2-1,否则类器官将具有更丰度的背侧AFE。对于LPC诱导,每次培养基更换时,必须将生长因子添加到碱基培养基中。如果培养基在LPC诱导后变黄,请考虑增加新鲜培养基的体积,或每天更换培养基。在3D全肺类器官诱导过程中,电镀数量和维持细胞簇是成功生长器官的关键。GFR基底膜基质介质难以处理且对温度高度敏感,因此请始终将其保持在冰上。如果GFR基底膜基质培养基过早凝胶,则LPC细胞将无法在其中整合。我们建议在传代前30分钟在冰上解冻1 mL等分试样的GFR基层膜基质培养基。一旦细胞/簇被计数并制作出适当的等分试样,将细胞沉淀放在冰上。我们建议在GFR基底膜基质培养基处理之前准备板,标记和添加细胞培养膜插入物。
使用移液器吸头将正确体积的GFR基底膜基质培养基质液体立即加入细胞沉淀中,并保持在冰上。快速但轻柔地上下移液(微妙的处理),以免引入气泡,然后将管子放回冰上。将细胞和GFR-基底膜基质培养基混合物加入到制备的板中转孔的顶端部分。混合物应扩散并涂覆整个横孔;轻轻倾斜板以确保涂层。在培养箱中凝胶化30-60分钟后,GFR-基底膜基质培养基中应有可见的细胞簇。将适当的肺诱导培养基加入补充10μM ROCK抑制剂Y-27632的基底室,并每隔一天监测一次类器官的生长。
该协议产生的类器官的未来应用包括研究控制早期肺谱系承诺和细胞命运规范的分子途径[21,22,23]。上皮细胞和间充质之间的相互作用可以通过利用基因敲除模型来确定[24]。类器官也可以与内皮细胞共培养,以确定肺上皮、间充质和内皮之间组织特异性共模式信号传导的重要性[25]。肺发育与血管发育同时发生,这种关系可能引发正常肺发育所必需的重要分子机制。我们还表明,在去除GFR-基底膜基质培养基后,然后在超低附着孔中进行短期培养后,这些全肺类器官通过表面活性剂分泌测定具有功能性[26]。其他策略包括对细胞进行分类以用于细胞表面标记物,例如NGFR(基底细胞)[27] 和HTII-280(ATII细胞)[28] ,并在气液相间培养条件下将其替换为均质类器官或单层。整个、近端和远端肺类器官也被用于研究SARS-CoV-2病毒感染的细胞靶标和病理生理学,以便更好地了解和筛查可能抗击COVID-19的药物。
该协议是健壮且可重复的,但仍然存在许多挑战。已经测试了许多不同的iPSC和ESC谱系(>20系),但必须针对每个细胞系优化方案。
尽管具有强大的DE和AFE诱导,但LPC诱导可能难以实现>40%的NKX2-1 +细胞。其他方案包括NKX2-1细胞表面标志物的分选步骤[15,18],但这些方案仅产生肺泡II型,如没有间充质的类器官,尽管纯化了肺祖细胞群,但仍含有胃细胞和肝细胞群[29]。我们还注意到LPC和全肺类器官中都有少量胃细胞和肝细胞,可能是由于背侧前前部细胞污染了LPC。
因此,纯肺类器官的分化尚未实现,必须完成对人体组织中肺祖细胞发育的更多研究。下游检测必须与原代人肺组织的基因和蛋白表达进行有力的基准测试。
虽然迄今为止,肺类器官最富有成效的用途是建模疾病和体外药物筛查,但将hiPSC衍生的肺类器官移植到患者体内用于再生医学已被考虑作为一系列疾病的未来疗法。然而,在考虑此类干预措施之前,必须完善大量的质量控制,包括识别和去除污染,不良,潜在致瘤性hiPSC衍生物。此外,还需要开发更好的体外功能测定和更好的肺部疾病动物模型。
具体而言,必须确认hiPSC衍生细胞的功能和安全性。需要排除未分化的细胞,因为它们具有产生畸胎瘤的能力。确定确定内胚层中未分化干细胞的一种方法是使用多能性标记SSEA4对细胞进行分类。最近使用单细胞RNA测序检测了未分化hiPSCs的标记基因[30]。ESRG,CNMD和SFRP2可用于在任何分化步骤中验证未分化的细胞。一旦纯度得到确认,自体iPSC衍生疗法的好处是移植细胞能够避免排斥反应,因为它们来自患者自身的细胞。缺点包括完全分化细胞,接受严格的临床级测试以及将细胞移植到急性损伤(呼吸窘迫综合征,心肌梗塞或脊柱损伤)的患者中所需的时间。另一种方法是利用银行同种异体iPSC衍生细胞[31]。这些可以储存起来,并且随时可供具有人白细胞抗原(HLA)匹配供体的患者使用,并且他们将接受全面的污染测试。最大的缺点是免疫排斥的可能性。在同种异体细胞移植中可能需要免疫抑制,这是同种异体全组织移植的当前现实。正在设计策略,以允许同种异体iPSC衍生细胞逃避免疫反应,以安全地将其移植到患者体内[32]。
最终,iPSC衍生的全肺类器官将用于研究患者特异性疾病模型,定制治疗方法,并加强再生医学研究。
Acknowledgements
这项研究得到了加州再生医学研究所(CIRM)(DISC2-COVID19-12022)的支持。
| Name | Company | Catalog Number | Comments |
|---|---|---|---|
| Cell Culture | |||
| 12 well plates | Corning | 3512 | |
| 12-well inserts, 0.4um, translucent | VWR | 10769-208 | |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Accutase | Innovative Cell Tech | AT104 | |
| ascorbic acid | Sigma | A4544 | |
| B27 without retinoic acid | ThermoFisher | 12587010 | |
| Bovine serum albumin (BSA) Fraction V, 7.5% solution | Gibco | 15260-037 | |
| Dispase | StemCellTech | 7913 | |
| DMEM/F12 | Gibco | 10565042 | |
| FBS | Gibco | 10082139 | |
| Glutamax | Life Technologies | 35050061 | |
| Ham’s F12 | Invitrogen | 11765-054 | |
| HEPES | Gibco | 15630-080 | |
| Iscove’s Modified Dulbecco’s Medium (IMDM) + Glutamax | Invitrogen | 31980030 | |
| Knockout Serum Replacement (KSR) | Life Technologies | 10828028 | |
| Matrigel | Corning | 354230 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR plus Kit (10/case) | Stem Cell Tech | 5825 | |
| N2 | ThermoFisher | 17502048 | |
| NEAA | Life Technologies | 11140050 | |
| Pen/strep | Lonza | 17-602F | |
| ReleSR | Stem Cell Tech | 5872 | |
| RPMI1640 + Glutamax | Life Technologies | 12633012 | |
| TrypLE | Gibco | 12605-028 | |
| Y-27632 (Rock Inhibitor) | R&D Systems | 1254/1 | |
| Growth Factors/Small Molecules | |||
| Activin A | R&D Systems | 338-AC | |
| All-trans retinoic acid (RA) | Sigma-Aldrich | R2625 | |
| BMP4 | R&D Systems | 314-BP/CF | |
| Br-cAMP | Sigma-Aldrich | B5386 | |
| CHIR99021 | Abcam | ab120890 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dorsomorphin | R&D Systems | 3093 | |
| EGF | R&D Systems | 236-EG | |
| FGF10 | R&D Systems | 345-FG/CF | |
| FGF7 | R&D Systems | 251-KG/CF | |
| IBMX (3-Isobtyl-1-methylxanthine) | Sigma-Aldrich | I5879 | |
| SB431542 | R&D Systems | 1614 | |
| VEGF/PIGF | R&D Systems | 297-VP/CF | |
| Primary antibodies | Dilution rate | ||
| CXCR4-PE | R&D Systems | FAB170P | 1:200 (F) |
| HOPX | Santa Cruz Biotech | sc-398703 | 0.180555556 |
| HTII-280 | Terrace Biotech | TB-27AHT2-280 | 0.145833333 |
| KRT5 | Abcam | ab52635 | 0.180555556 |
| NKX2-1 | Abcam | ab76013 | 0.25 |
| NKX2-1-APC | LS-BIO | LS-C264437 | 1:1000 (F) |
| proSPC | Abcam | ab40871 | 0.215277778 |
| SCGB3A2 | Abcam | ab181853 | 0.25 |
| SOX2 | Invitrogen | MA1-014 | 0.180555556 |
| SOX9 | R&D Systems | AF3075 | 0.180555556 |
| SPB (mature) | 7 Hills | 48604 | 1: 1500 (F) 1:500 (W)a |
| SPC (mature) | LS Bio | LS-B9161 | 1:100 (F); 1:500 (W) a |
References
- Ten Have-Opbroek, A. A. Lung development in the mouse embryo. Experimental Lung Research. 17 (2), 111-130 (1991).
- Perl, A. K., Whitsett, J. A. Molecular mechanisms controlling lung morphogenesis. Clinical Genetics. 56 (1), 14-27 (1999).
- Leibel, S., Post, M. Endogenous and exogenous stem/progenitor cells in the lung and their role in the pathogenesis and treatment of pediatric lung disease. Frontiers in Pediatrics. 4, 36 (2016).
- Hines, E. A., Sun, X. Tissue crosstalk in lung development. Journal of Cellular Biochemistry. 115 (9), 1469-1477 (2014).
- Montoro, D. T., et al. A revised airway epithelial hierarchy includes CFTR-expressing ionocytes. Nature. 560 (7718), 319-324 (2018).
- Barkauskas, C. E., et al. Type 2 alveolar cells are stem cells in adult lung. The Journal of Clinical Investigation. 123 (7), 3025-3036 (2013).
- D’Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Green, M. D., et al. Generation of anterior foregut endoderm from human embryonic and induced pluripotent stem cells. Nature Biotechnology. 29 (3), 267-272 (2011).
- Ikeda, K., Shaw-White, J. R., Wert, S. E., Whitsett, J. A. Hepatocyte nuclear factor 3 activates transcription of thyroid transcription factor 1 in respiratory epithelial cells. Molecular Cell Biology. 16 (7), 3626-3636 (1996).
- Schittny, J. C. Development of the lung. Cell and Tissue Research. 367 (3), 427-444 (2017).
- Mecham, R. P. Elastin in lung development and disease pathogenesis. Matrix Biology: Journal of the International Society for Matrix Biology. 73, 6-20 (2018).
- Bellusci, S., Grindley, J., Emoto, H., Itoh, N., Hogan, B. L. Fibroblast growth factor 10 (FGF10) and branching morphogenesis in the embryonic mouse lung. Development. 124 (23), 4867-4878 (1997).
- Bellusci, S., et al. Involvement of Sonic hedgehog (Shh) in mouse embryonic lung growth and morphogenesis. Development. 124 (1), 53-63 (1997).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nature Methods. 14 (11), 1097-1106 (2017).
- Hawkins, F., et al. Prospective isolation of NKX2-1-expressing human lung progenitors derived from pluripotent stem cells. The Journal of Clinical Investigation. 127 (6), 2277-2294 (2017).
- McCauley, K. B., Hawkins, F., Kotton, D. N. Derivation of epithelial-only airway organoids from human pluripotent stem cells. Current Protocols in Stem Cell Biology. 45 (1), 51 (2018).
- Miller, A. J., et al. Generation of lung organoids from human pluripotent stem cells in vitro. Nature Protocols. 14 (2), 518-540 (2019).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Reports. 3 (3), 394-403 (2014).
- Huang, S. X., et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells. Nature Biotechnology. 32 (1), 84-91 (2014).
- Endale, M., et al. Temporal, spatial, and phenotypical changes of PDGFRα expressing fibroblasts during late lung development. Developmental Biology. 425 (2), 161-175 (2017).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246-254 (2016).
- Nikolić, M. Z., Rawlins, E. L. Lung organoids and their use to study cell-cell interaction. Current Pathobiology Reports. 5 (2), 223-231 (2017).
- Calvert, B. A., Ryan Firth, A. L. Application of iPSC to modelling of respiratory diseases. Advances on Experimental Medicine and Biology. 1237, 1-16 (2020).
- McCulley, D., Wienhold, M., Sun, X. The pulmonary mesenchyme directs lung development. Current Opinion in Genetics and Development. 32, 98-105 (2015).
- Blume, C., et al. Cellular crosstalk between airway epithelial and endothelial cells regulates barrier functions during exposure to double-stranded RNA. Immunity, Inflammation and Disease. 5 (1), 45-56 (2017).
- Leibel, S. L., et al. Reversal of surfactant protein B deficiency in patient specific human induced pluripotent stem cell derived lung organoids by gene therapy. Scientific Reports. 9 (1), 13450 (2019).
- Rock, J. R., et al. Basal cells as stem cells of the mouse trachea and human airway epithelium. Proceedings of the National Academy of Sciences of the United States of America. 106 (31), 12771-12775 (2009).
- Gonzalez, R. F., Allen, L., Gonzales, L., Ballard, P. L., Dobbs, L. G. HTII-280, a biomarker specific to the apical plasma membrane of human lung alveolar type II cells. The Journal of Histochemistry and Cytochemistry: Official Journal of the Histochemistry Society. 58 (10), 891-901 (2010).
- McCauley, K. B., et al. Single-cell transcriptomic profiling of pluripotent stem cell-derived SCGB3A2+ airway epithelium. Stem Cell Reports. 10 (5), 1579-1595 (2018).
- Sekine, K., et al. Robust detection of undifferentiated iPSC among differentiated cells. Scientific Reports. 10 (1), 10293 (2020).
- Jacquet, L., et al. Strategy for the creation of clinical grade hESC line banks that HLA-match a target population. EMBO Molecular Medicine. 5 (1), 10-17 (2013).
- Mattapally, S., et al. Human leukocyte antigen class I and II knockout human induced pluripotent stem cell-derived cells: universal donor for cell therapy. Journal of the American Heart Association. 7 (23), 010239 (2018).
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/07/从诱导多能干细胞生成3D全肺类器官,用于模拟肺发育生物学和疾病/
- 版权声明: 转载请注明出处,谢谢。

