[TOC]
First Published: November 3rd, 2020
DOI:10.3791/61855
MyNotes:
本文作者的研究工作集中于运用CRISPR/Cas9基因编辑技术在人类B细胞中进行基因敲除(KO)和敲入(KI)操作,以便深入研究B细胞中特定基因的功能,并将其应用于B细胞疗法的开发。这项研究创新性地优化了从外周血单核细胞(PBMCs)中分离、扩增B细胞的流程,同时改进了CRISPR/Cas9系统的转染效率和安全性。
实验过程中,作者首先采用了一套高效且标准化的步骤分离并大量扩增B细胞,使其能在7天内增加44倍,这对于后续基因编辑的成功至关重要。然后,利用电穿孔技术将CRISPR/Cas9 mRNA与针对CD19基因的sgRNA导入B细胞,以实现CD19基因的精准敲除。实验结果显示,这种方法成功诱导了预期的双链断裂(DSB),并通过非同源末端连接(NHEJ)机制引起了CD19基因的失活,其有效性通过流式细胞术和TIDE(Tracking of Indels by Decomposition)分析得到验证,结果显示CD19蛋白的表达显著减少。
此外,作者还展示了如何利用CRISPR/Cas9与重组腺相关病毒(rAAV6)载体结合,将绿色荧光蛋白(EGFP)基因特异整合到AAVS1位点,实现了高效的基因敲入。实验结果显示,经过工程化的B细胞在12天后能稳定表达EGFP,并且通过PCR和流式细胞术证实了基因整合的发生。
尽管如此,研究也指出CRISPR/Cas9技术存在潜在的脱靶效应和染色体易位风险,因此作者强调了优化实验条件的重要性,比如选择合适的sgRNA以降低脱靶效应,并探讨了使用碱基编辑器作为更为精确的基因编辑手段的可能性。
具体实验步骤流程概括可以如下:
B细胞分离与激活:
- 从外周血单核细胞(PBMCs)中分离B细胞,通过密度梯度离心法和负选择试剂盒进行纯化。
- 对分离出的B细胞进行体外扩增,每两天更换新鲜的激活因子,并严格控制细胞密度。
CRISPR/Cas9介导的基因敲除(KO):
- 设计并合成针对目标基因(如CD19)的sgRNA。
- 制备CRISPR/Cas9-sgRNA复合物,通过电穿孔技术将复合物导入B细胞。
- 经过电穿孔后的细胞在特定时间内静置和恢复,随后进行细胞培养。
- 在转染后的第5天,使用流式细胞术检测CD19表达水平,并通过TIDE分析确定DNA双链断裂后引发的Indel形成。
基因敲入(KI)实验:
- 使用重组腺相关病毒(rAAV6)载体携带目的基因(如EGFP)和同源臂。
- 将CRISPR/Cas9系统与rAAV6载体一同导入B细胞,诱导同源定向修复(HDR)介导的敲入。
- 工程化后的第12天,通过流式细胞术和PCR分析评估EGFP基因是否成功整合及表达。
整个实验流程旨在通过精细调控B细胞的分离、激活和基因编辑过程,高效地实现对B细胞基因组的精准工程改造,进而研究基因功能及其在B细胞治疗中的应用潜力。同时,实验关注了优化细胞健康和基因编辑效率的关键步骤,以及对可能存在的脱靶效应和染色体易位等问题的考量。
Summary
在这里,我们为CRISPR/Cas9基础基因组工程提供详细的分步协议,用于基因敲除(KO)和敲击(KI),以研究B细胞中基因的生物功能和B细胞治疗的开发。
Abstract
B细胞是从造血干细胞中提取的淋巴细胞,是适应性免疫系统幽默手臂的关键组成部分。他们之所以成为细胞疗法的候选者,是因为它们容易与周围血液隔离,体外扩张能力,以及体内寿命。此外,它们的正常生物功能——产生大量的抗体——可以用来表达大量的治疗性蛋白质,如抗感染的重组抗体,或用于治疗酶病变的酶。在这里,我们提供详细的方法,将原人类B细胞从外周血单核细胞(PBMCs)中分离,并在体外激活/扩大分离的B细胞。然后,我们演示了使用CRISPR/Cas9系统在B细胞中针对内源基因的部位特定KO所涉及的步骤。这种方法可以有效地利用各种基因的KO,用于研究感兴趣的基因的生物功能。然后,我们演示了使用CRISPR/Cas9系统以及重组的、与腺相关的病毒(rAAV)载体的步骤,以有效实现B细胞中转基因表达盒的现场特定集成。该协议共同提供了一个分步工程平台,可用于人类B细胞的初级研究基因的生物功能以及B细胞治疗的开发。
Introduction
B细胞是来自造血干细胞的淋巴细胞系的子群。他们在适应性幽默免疫系统中发挥关键作用,产生大量的抗体来应对免疫挑战[1]。B细胞也是记忆B细胞和最终分化的长寿血浆细胞的前体,从而提供持久的幽默免疫力[2]。特别是等离子体细胞,在免疫细胞中独一无二,它们能够产生大量的特定抗体,同时存活多年或几十年。此外,从外周血液隔离的便利性使B细胞血统成为新细胞疗法[4]的极好候选者。
以前,随机整合方法,如那些使用扁桃体载体或睡美人转子,已经被用来工程B细胞的转基因传递和表达[5,6,7,8]。然而,这些方法的非特异性使得研究B细胞中特定基因的生物功能变得困难,并具有在治疗环境中插入突变和可变转基因表达和/或沉默的固有风险。
CRISPR/Cas9系统是一个强大的基因组工程工具,使研究人员能够精确编辑许多物种中各种细胞的基因组。最近,包括我们自己的两组已经成功地开发出了原始人类B细胞[9,10]的外活扩张和靶向基因组工程方法。我们将描述从白血病样本中净化原人类B细胞的过程。之后,我们将描述我们更新的 B 细胞扩展和激活孤立 B 细胞的协议。然后,我们将描述一个通过电波将CRISPR/Cas9 mRNA与CD19 sgRNA一起引入激活的B细胞,从而敲除分化19(CD19)的簇、特定的B细胞受体和B细胞的标志的过程。
Cas9 mRNA 被翻译并绑定到 CD19 sgRNA,以形成 CRISPR/Cas9-sgRNA 核糖核蛋白复合物 (RNP)。随后,复合物中的sgRNA导致Cas9在基因exon2上的目标序列中产生双链断裂(DSB)。细胞将通过引入或删除核苷酸来修复DSB,导致帧移位突变并导致基因被消灭。然后,我们将用流细胞测量测量CD19的损失,并通过分解(TIDE)分析对英德尔的形成进行跟踪分析。
代表结果解读
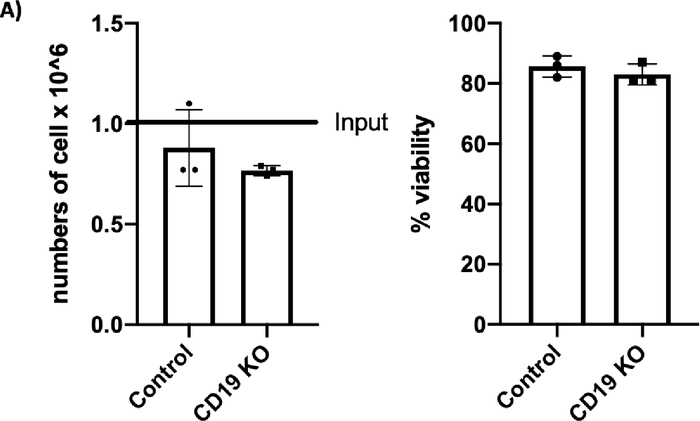
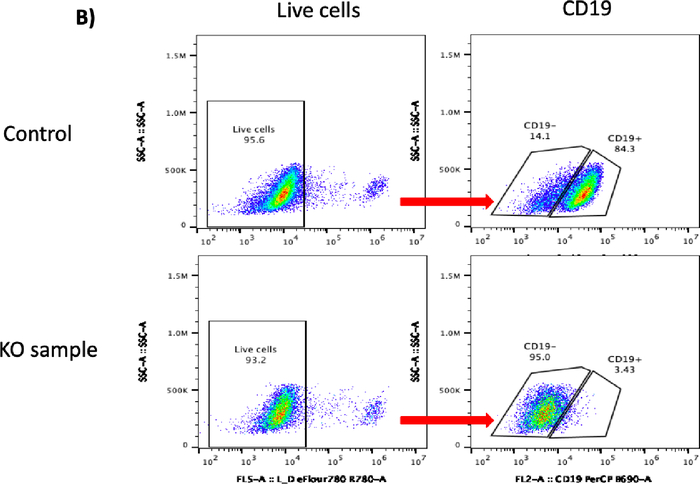
更新的扩增和激活协议能够在7天内将B细胞快速扩增至44倍(图1;n = 3个捐赠者)。在KO实验中,使用 Trypan 蓝染色测定的B细胞计数显示,电穿孔后24小时,对照组和CD19 KO样本的存活率均超过80%,但细胞回收略有下降(图2A;p ≥ 0.05,n = 3个捐赠者)。这一结果表明,电穿孔对B细胞的整体健康略有影响。在转染后的第5天收集B细胞进行流式细胞术和TIDE分析。对照组和KO样本的代表性散点图显示,分别为14%和95%的CD19阴性细胞(图2B)。流式细胞术图的定量分析显示,与对照组相比,KO样本的CD19表达显著降低(图2B;p ≤ 0.0001,n = 3个捐赠者)。
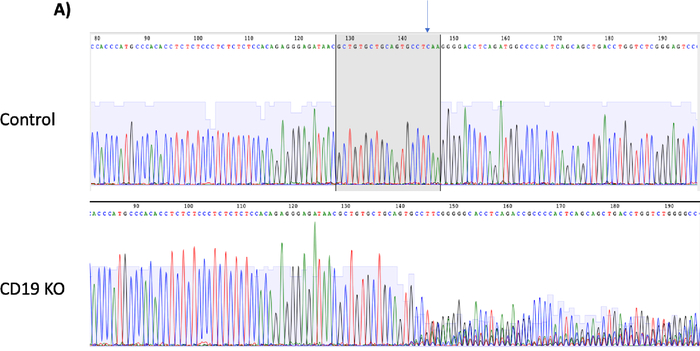
基因组测序的色谱图(见表3中的引物序列)在CD19 KO B细胞中显示双峰,表明在CRISPR/Cas9介导的DSB后发生了核苷酸的插入/缺失,而在对照组中观察到单峰,表明此样本中未发生DSB(图3A)。KO样本的Indel分析色谱图(使用一个免费的在线TIDE分析工具)在CD19位点上的Indel形成百分比很高(>90%),这与流式细胞术检测到的CD19蛋白损失百分比一致(图3B;p ≥ 0.05,n = 3个捐赠者)。这些结果表明,CRISPR/Cas9有效地在B细胞中产生了CD19 KO。
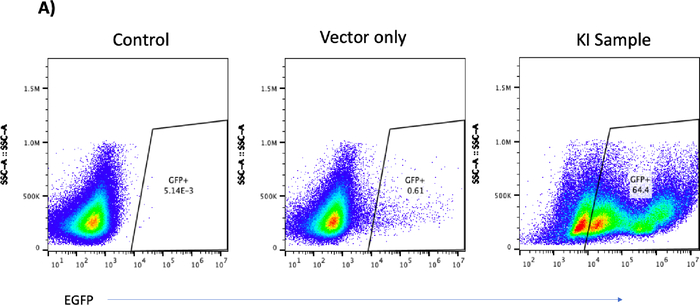
KI实验的B细胞在工程化后的第12天收集,用于流式细胞术和连接PCR分析(表4)。接收rAAV6载体的样本的散点图显示EGFP阳性细胞占64%(图4),而在对照组中没有观察到EGFP阳性细胞;仅接收AAV载体的样本中观察到最小的EGFP阳性(图5A)。连接PCR扩增(见表3中的引物序列)在KI样本中显示出1.5 Kbps的扩增子(图5B),而在对照组或仅接收载体的样本中没有观察到PCR产物。细胞计数显示,工程化过程对KI样本的细胞回收影响大于对照组或仅接收载体的样本(图5B)。然而,所有样本在工程化后的3天内迅速恢复(图5B)。这些结果表明,成功在AAVS1位点整合EGFP至少在工程化后的12天内能够稳定表达EGFP。
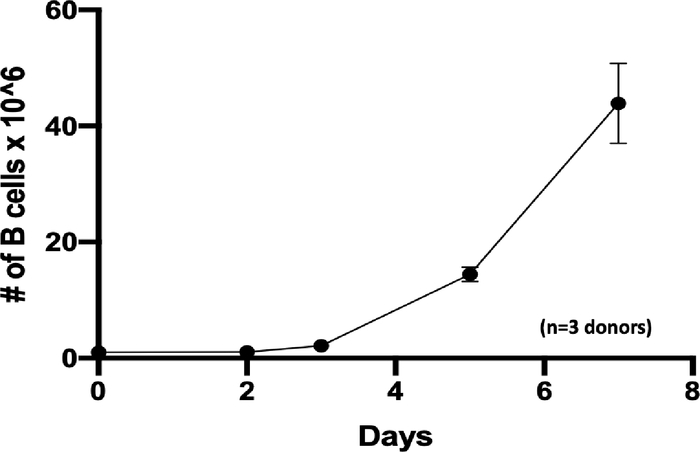
[^图1:体外B细胞扩张]: B细胞在第0天(零)在1个×106 个细胞播种,密度为5×每mL105, 并在7天内扩大44倍(n=3独立捐赠者)。
[^图2A]:
[^图2B]:
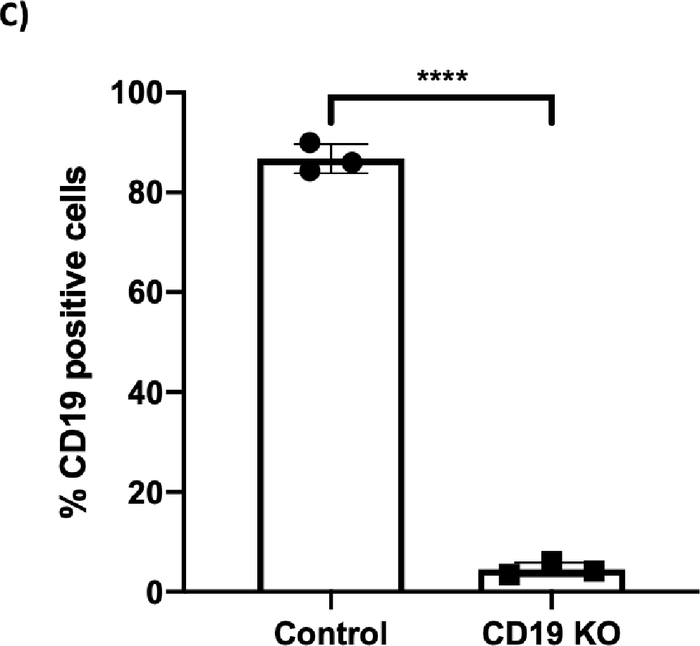
[^图2C]: CRISPR/Cas9介质CD19淘汰赛(KO)在B细胞中。(A) 条形图显示 & gt;70% 细胞恢复(左面板)和 >80% 的存活率 (右面板) 细胞在输电后 24 小时在控制和 CD19 KO 样本中观察到。(B) 活细胞CD19门控的代表流动图分别显示对照样本和CD19 KO样本中84.3%和3.43%的CD19阳性细胞。(C) 条形图显示 CRISPR/Cas9 介控 CD19 KO 组 CD19 显著减少(p ≤ 0.0001)。
然后,我们将描述使用CRISPR/Cas9与重组AAV6载体(rAAV6,同源定向修复(HDR)的捐赠模板)一起,以调解在腺相关病毒集成站点1(AAVS1)基因中插入增强型绿色荧光蛋白(EGFP) 的现场特定插入过程。AAVS1基因是一种没有已知生物功能的活性球体,也是人类基因组上的AAV病毒整合站点:因此,它被认为是基因组工程的”安全港”。在这里,我们报告说,B细胞的膨胀和激活允许在7天的培养中扩大44倍(图1)。B细胞的电扩散显示,在24小时后,整体细胞健康(图2A)略有下降。对 CD19 标记(图 2B)的分散图分析显示编辑的单元块(图 2C)减少高达83%。
[^图3A]:
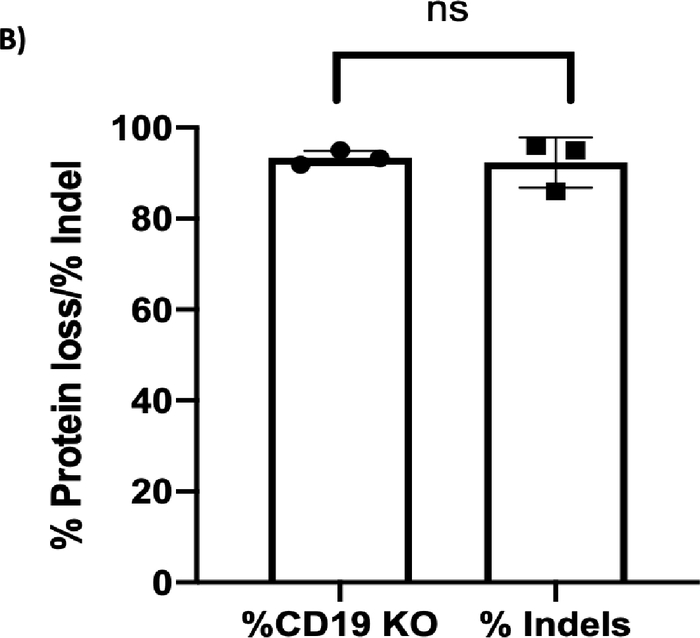
[^图3B]: CD19蛋白质损失与英德尔形成。(A) 色谱图描绘了控制和 CD19 淘汰 (KO) 样本的测序峰值。控制峰值上的灰色框突出显示 CD19 gRNA 的目标序列,并带有箭头指示的预测切割位置。CD19 KO 显示”双峰”测序围绕预测的切割点,指示在双链断裂后插入/删除核苷酸。(B) 条形图显示 CD19 蛋白质损失百分比与 CD19 轨迹(p ≥ 0.05)的英德尔形成之间的一致结果。

[^图4:rAAV6 AAVS1 MND-GFP矢量构造。]: ****表达盒包含一个强大的合成促进器 (MND) 序列,紧接着是增强的绿色荧光蛋白 (EGFP) 编码序列和聚腺素化 (Poly A) 序列。AAVS1 同源臂侧翼在 MND 发起器上游和聚 A 序列的下游。EGFP 将根据 MND 发起人的法规进行表达。在构造的每个组件上方指示序列长度。
[^图5A]:

[^图5B]:
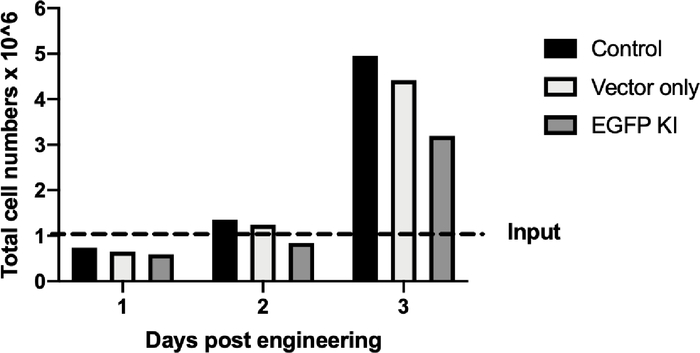
[^图5C]: CRISPR/Cas9-和rAAV6在工程后第12天将EGFP记者录音带在B单元中的具体集成。(A) 代表流图显示控制或仅矢量样本中无EGFP阳性 B 细胞,而敲击 (KI) 样本中 EGFP 阳性 B 细胞为 64.4%。(B) KI样品的交界聚合酶链反应显示预测的1.5 Kbps波段:在控制或仅矢量样本中未发现带。在 PCR 过程中,水用于确保无污染。(C) 条形图描绘了在工程后 3 天内控制、仅矢量和 EGFP-KI 样本的细胞生长。断线表示 1 × 106 单元输入。
TIDE对色谱仪(图3A)的分析显示,英德尔的百分比与流动细胞仪(图3B)所导致的蛋白质损失相似。KI实验的流动细胞学分析表明,接受AAV载体(图4)的细胞与RNP一起表示高达64%的EGFP阳性细胞(图5A),随后通过结点聚合酶链反应(PCR)(图5B)显示成功整合。细胞计数显示,所有样本在工程后3天内迅速恢复(图5C)。
protocol
从当地血库获得了健康捐赠者的白细胞分离样本。在此描述的所有实验均被明尼苏达大学的机构审查委员会(IRB)认定为研究豁免,并获得了机构生物安全委员会(IBC)的批准。
注意:所有实验均按照血源性病原体的通用预防措施进行,使用无菌/无菌技术和适当的生物安全二级设备。
将CpG寡核苷酸复溶至1 mg/mL的浓度。
将CD40配体(CD40L)复溶至100 μg/mL的浓度。
将重组人IL-10(rhIL-10)复溶至50 μg/mL的浓度。
将重组人IL-15(rhIL-15)复溶至10 μg/mL的浓度。
注意:将每种补充剂分装成小份,在-20°C至-80°C下保存,最多可保存6个月。
将B细胞基础培养基与5%(体积/体积)的体外免疫细胞扩增培养基补充剂(例如,CTS免疫细胞SR)和1%(体积/体积)的青霉素和链霉素混合。
使用0.22 µm过滤器适配器对基础培养基进行过滤灭菌,装入已灭菌的瓶子中。
将基础培养基在4°C下保存,最多可保存1个月。
将所需量的基础培养基转移到无菌容器中,以5 × 10^5细胞/mL的密度培养B细胞。
用1 μg/mL CpG、100 ng/mL CD40L、50 ng/mL rhIL-10和10 ng/mL rhIL-15补充基础培养基。
使用0.22 µm过滤器过滤B细胞扩增培养基。
在使用前,将B细胞扩增培养基在37°C、5% CO2、湿度条件下在组织培养孵箱中平衡至少30分钟。
注意:准备新鲜的B细胞扩增培养基以供当天使用。不要准备用于多天的B细胞扩增培养基。此培养基配方鼓励记忆B细胞和激活的原代人B细胞的增殖。
注意:按照制造商的说明,在开始第4.1步之前,向温控冷冻容器中加入99-100%异丙醇,并将冷冻容器在4°C下冷却。
从白细胞分离样本中分离出外周血单核细胞(PBMC)
- 将大约8-10 mL的白细胞分离样本转移到无菌的50 mL锥形管中。
- 用无菌的1x磷酸盐缓冲液(PBS)将体积补至35 mL。
- 小心地将35 mL白细胞分离样本层叠在15 mL密度梯度介质上。
- 在500 × g下离心25分钟,不使用制动,去除血浆层,不要扰动富含单核细胞的层(PBMC层),从界面收集PBMCs,并转移到新的无菌50 mL锥形管中。
- 用1x PBS将PBMCs的体积补至50 mL。
- 在500 × g下离心5分钟,不使用制动。去除上清液,不要扰动可能呈现红色的PBMC沉淀。
- 加入7 mL的氯化铵-氯化钾溶胞缓冲液,用移液管轻轻吹打混合3次,并在室温(RT)下孵育3分钟。
- 用1x PBS将体积补至50 mL。
- 在400 × g、低阻力制动的条件下离心5分钟。去除上清液,不要扰动沉淀。沉淀应呈粉红色或白色。
注意:为了继续培养新鲜分离的B细胞,请在开始B细胞分离(第4.2步)之前准备B细胞扩增培养基。
使用人原代B细胞负选试剂盒从PBMCs中分离B细胞
- 用隔离缓冲液将PBMCs重新悬浮至5 × 10^7细胞/mL的浓度。
注意:如果PBMC总数少于5 × 10^7细胞,则减少隔离缓冲液的体积以保持5 × 107细胞/mL。细胞悬浮液的最小和最大体积分别为0.25 mL和8 mL。 - 将最多8 mL(5 × 10^7细胞/mL)转移到带有盖子的无菌、聚丙烯、圆底试管中。
- 向PBMCs中加入50 μL/mL的Cocktail增强剂。
- 向PBMCs中加入50 μL/mL的隔离鸡尾酒,盖上试管盖,倒置2-3次以混合。
- 在RT下孵育5分钟;在孵育的第4分钟,至少30秒涡旋磁性微球。
- 每1 mL PBMCs转移50 μL磁性微球,盖上试管盖,倒置2-3次以混合。
- 用隔离缓冲液补至10 mL,并轻轻上下吸液2-3次。
- 将试管放在磁性站中,在RT下孵育3分钟。
- 握住磁铁和试管,将磁铁和试管一起倒置,将细胞悬浮液倒入新试管中。丢弃旧试管。
- 重复步骤4.2.8(将孵育时间减少至2分钟),并将B细胞悬浮液倒入干净的锥形管中。
- 富集的B细胞准备使用。如果立即使用细胞,请继续第4.3节(人B细胞扩增)。通过流式细胞术(可选)检查分离的B细胞的纯度。如果在使用前需要冷冻细胞,请继续步骤4.2.12。
- 为了冷冻B细胞,在400 × g下离心5分钟,去除上清液,不要扰动沉淀。
- 用冷冻培养基以10^7细胞/mL的浓度重新悬浮细胞,并分装到1 mL/冻存管中。
- 将冻存管放入冷却的冷冻容器中,在-80°C下储存过夜;然后,将冷冻的冻存管转移到液氮罐中;可保存冻结细胞长达1年。
注意:预计分离的B细胞产量为总PBMC的2%-8%,存活率为95%-99%。
- 用隔离缓冲液将PBMCs重新悬浮至5 × 10^7细胞/mL的浓度。
人B细胞扩增
注意:如果使用新鲜分离的B细胞,请跳过步骤4.3.1-4.3.5。计数细胞,并将所需数量的细胞转移到无菌锥形管中,然后继续进行步骤4.3.6。
- 在使用前,将胎牛血清(FBS)在温水浴中预温。准备20 mL的B细胞扩增培养基,转移到T25烧瓶中,并在使用前至少15分钟在组织培养孵箱中预平衡培养基(在37°C、5% CO2、湿度的条件下)。
- 在37°C水浴中解冻B细胞。等待期间,将2 mL预热的FBS转移到无菌的15 mL锥形管中。
- B细胞完全解冻后,立即向样本中逐滴加入1 mL预热的FBS,并在RT下孵育1分钟。
- 轻轻吸液以重新悬浮样本,并将整个体积逐滴转移到含有2 mL预热的FBS的锥形管中。
- 用无菌的1x PBS将体积补至15 mL,盖上试管盖,轻轻倒置2-3次。
- 在400 × g下离心5分钟。
- 去除上清液,不要扰动细胞沉淀,用1 mL预平衡的B细胞扩增培养基重新悬浮细胞沉淀,并计数细胞。总细胞数应约为10^7细胞。
- 将细胞转移到含有20 mL预平衡的B细胞扩增培养基的烧瓶中。细胞的最终浓度应约为5 × 10^5细胞/mL。
- 垂直将烧瓶放入组织培养孵箱中孵育。
- 每2天通过将B细胞的全部体积转移到无菌锥形管中并重复步骤4.3.6-4.3.9来完全更换扩增培养基。
注意:T25烧瓶可以容纳10-20 mL的培养基;T75烧瓶可以容纳多达20-60 mL的培养基。
五、人原代B细胞的工程化处理
为了获得最佳结果,在扩增/激活后的48 ± 2小时对B细胞进行工程化处理。准备B细胞扩增培养基,将1 mL培养基分装到48孔组织培养板中,并在使用前至少15分钟在组织培养孵箱中预平衡。
注意:在设计CRISPR/Cas9 sgRNA进行基因编辑时,请遵循以下步骤。
1)使用在线工具设计sgRNAs。
2)在所有蛋白质变体的共有外显子上设计sgRNAs。
3)从信誉良好的公司订购化学修饰的sgRNA。
4)sgRNA通常以冻干形式提供;用无菌的DNase/RNase-free Tris-EDTA(TE)缓冲液复溶sgRNA,浓度为1 μg/μL。
1. 通过将每个转染反应中的1 μL(1 μg/μL)化学修饰的sgRNA与1.5 μL(1 μg/μL)化学修饰的链球菌Cas9(S.p. Cas9)核酸酶混合来准备CRISPR/Cas9转染底物。对于对照组,使用1 μL TE缓冲液代替sgRNA。
注意:当使用CD19 sgRNA进行基因敲除(KO)实验时,请参阅图2的结果。当使用AAVS1 sgRNA进行基因敲入(KI)实验时,请参阅图5的结果。
**将所有组分保持在冰上。**
2. 轻轻混合,并将每个反应的2.5 μL CRISPR/Cas9转染底物转移到0.2 mL 8管条的管中;在室温下放置备用。
3. 打开核转染仪(电穿孔仪),并准备转染试剂,如表格1所示。
注意:如果需要,这是一个暂停的好步骤,将所有试剂放在冰上。准备好继续实验时,从冰上取下所有试剂。使用S.p. Cas9蛋白时,研究者必须通过将1 μg sgRNA与5 μg SpCas9蛋白混合,避免产生气泡,并在使用前在室温下孵育至少20分钟以获得最佳结果。
4. 计数并将每10^6个B细胞转移到无菌锥形管中进行转染反应。
5. 用无菌的1x PBS将体积补至15 mL,并在400 × g下离心5分钟。等待时,准备主要细胞转染试剂(表格2)并在室温下放置备用。
6. 去除上清液,不要扰动细胞沉淀。
7. 用10 mL无菌的1x PBS重新悬浮细胞沉淀,并在400 × g下离心5分钟。
8. 完全去除上清液,不要扰动细胞沉淀。
9. 向每10^6个B细胞的细胞沉淀中转移0.5 μg化学修饰的GFP mRNA(作为转染报告物,可选)。
10. 用每10^6个B细胞的20 μL主要细胞转染试剂重新悬浮细胞沉淀;轻轻通过吸液5-6次混合。将每个反应的20.5 μL转移到含有2.5 μL CRISPR/Cas9转染底物的0.2 mL管中。
11. 上下吸液一次以混合,并将整个体积(23 μL)转移到转染槽中。盖上盖子,轻轻在台面上敲打试管,以确保液体覆盖槽的底部。
12. 使用核转染仪的人原代B细胞协议进行转染。
注意:核转染仪(电穿孔仪)可以放在组织培养罩外使用。盖上盖子以确保无菌。
13. 让电穿孔后的细胞在室温下静置15分钟。
14. 从组织培养板中转移80 μL预平衡的B细胞扩增培养基到转染反应的试管中。将试管放入组织培养孵箱中孵育30分钟。
15. 轻轻吸液几次以混合,并将试管中的样本整体转移到48孔组织培养板中适当孔内,含有1 mL B细胞扩增培养基的孔中。细胞的最终浓度应为10^6细胞/mL。
16. 如果进行基因敲入实验,则在电穿孔后大约45分钟,将rAAV6载体以500,000感染复数转移到含有电穿孔细胞的适当孔中。请参阅图4A的rAAV6载体构建示例。
注意:例如:对照样本将不使用CRISPR/Cas9或rAAV6载体进行电穿孔。仅载体样本将不使用CRISPR/Cas9进行电穿孔,然后使用rAAV6载体进行转导。敲入(KI)样本将使用CRISPR/Cas9进行电穿孔,然后使用rAAV6载体进行转导。rAAV6必须在其靶向DSB位点上下游含有同源臂,以进行同源定向修复(HDR)。
17. 将培养板放入37°C、5% CO2湿度的组织培养孵箱中。
18. 在工程化处理后的第1天计数细胞并记录存活率。
19. 每2天通过计数细胞并将细胞的全部体积转移到干净的1.5 mL微量离心管中,然后离心以400 ×g离心5分钟,去除上清液,不要扰动沉淀。用100 µL新鲜的B细胞扩增培养基重新悬浮细胞,并转移到24孔组织培养板的孔中。将培养基体积补至最终细胞浓度达到5 × 10^5细胞/mL。
注意:48孔板每孔最多可容纳1 mL培养基;24孔板每孔最多可容纳2 mL培养基;12孔板每孔最多可容纳4 mL培养基;6孔板每孔最多可容纳8 mL培养基。
20. 在至少扩增5天后再进行下游分析,如流式细胞术分析、TIDE分析和连接PCR。
讨论
直到最近,对原代人B细胞进行精确的基因组工程仍然是一个挑战。我们之前发表的协议使用了CRISPR/Cas9来工程化原代人B细胞。在这里,我们概述了改进的B细胞分离、扩增和工程化协议,以实现对CD19的快速KO或对EGFP的敲入。
我们证明,我们的扩增协议可以在7天内将B细胞快速扩增至44倍(图1)。这个协议的扩增速率比Johnson等人和Hung等人的报告更快。确保原代人B细胞健康快速扩增的关键步骤是每两天用新鲜的激活因子替换培养基,并确保培养中的总B细胞数不超过2 × 106细胞/mL。
我们还发现,我们改进的CRISPR/Cas9转染协议对CD19 KO结果在效率上很高(图2和图3)。与之前的研究一样,我们观察到电穿孔后24小时细胞回收和存活率略有下降。这表明电穿孔会影响原代人B细胞的整体健康;然而,细胞最终在48小时内恢复(数据未显示)。
使用这种电穿孔器协议的好处是,我们可以以更快的速度(16个反应在1分钟内完成),而之前的协议(9,10)完成16个反应大约需要10-12分钟。此外,这个转染系统消除了之前研究中观察到的电穿孔器可能产生的电弧(9,10)。此外,这个工程化方法可以扩大规模,用于更大数量的B细胞,使用更大型的、商业上可获得的槽(数据未显示)。
为了确保最佳的细胞整体健康和KO效率,有几个关键步骤:首先,确保B细胞扩增培养基制备并预平衡至少15分钟后使用。其次,转染底物的总体积不应超过核转染试剂的20%(体积/体积)。第三,必须扩增/激活48 ± 2小时以获得最佳结果。第四,在将电穿孔槽放入电穿孔器之前,轻轻敲打电穿孔槽,以确保转染反应溶液覆盖槽底。第五,确保电穿孔后的细胞在电穿孔槽中仅静置15分钟;电穿孔后长时间留在核转染试剂中可能会损害整体细胞存活率。第六,确保将细胞与培养基在电穿孔槽中的孵育时间不超过30分钟。第七,将106个电穿孔细胞放入1 mL中,在最初的48小时内,这有助于细胞更快恢复,而不是在较低的密度下培养(数据未显示)。最后,使用Cas9 mRNA或Cas9蛋白将导致类似的编辑效率(数据未显示);然而,我们为了方便和成本效益使用了Cas9 mRNA。
在使用CRISPR/Cas9时,有两个主要担忧:脱靶效应和染色体易位。由于sgRNA与目标序列不匹配的碱基对引起的脱靶效应,导致基因组上可能存在许多可能的结合位点,并产生多个不需要的基因KO。因此,应同时考虑预测的脱靶评分和on-target评分,以尽量减少这个问题。染色体易位可能由于脱靶效应或在敲除多个基因时发生。这可能在实验和临床上造成灾难性事件。碱基编辑器(12种:两种类型的胞嘧啶碱基编辑器和腺嘌呤碱基编辑器)改变一个核苷酸(破坏剪接元件、创建过早终止密码子或创建点突变),导致目标基因KO而不产生DSB(在其他地方详细回顾)。因此,碱基编辑方法可用于单基因或多基因KO,以规避染色体易位问题。
我们还证明,CRISPR/Cas9与rAAV6一起,可以用于高效介导特异性KI,并在AAVS1位点表达EGFP。我们在工程化后的至少12天内观察到EGFP表达。我们还观察到KI样本在第12天有两个EGFP阳性群体:一个高表达群体和一个中表达群体(图5A),而仅接收载体的样本显示出最小比例的细胞中存在中表达EGFP。我们推测这种“高和中表达群体”的现象是由于载体双等位基因整合造成的。进一步使用跨越PCR对中和高表达EGFP细胞进行调查可以确认这个假设。使用AAV作为载体的两个注意事项:首先,AAV载体具有有限的货物容量,高达4.7千字节,当敲入大基因时会引起问题。减少同源臂的大小将允许容纳更大的基因,从而降低KI效率(数据未显示)。或者,可以使用多个基因装载载体的同时或顺序整合。研究报道了在免疫健全的动物模型中AAV转导细胞会产生免疫反应并清除这些细胞。作为替代方案,可以探索非病毒基础的供体HDR模板,以规避这个问题。
总之,我们已经证明了从分离、扩增到B细胞工程化的全面、分步过程,这些过程导致了高基因修改效率。这种工程化方法可以用于基因敲除,并研究B细胞中基因的功能。此外,这种方法可以用于工程化B细胞以表达重组抗体,用于对抗感染。最后,这种方法可以应用于工程化B细胞以表达和分泌治疗酶,这些酶可以作为自体细胞为基础的治疗方法,用于治疗酶病。
在未来的研究中,我们可以进一步优化这些协议,提高基因编辑的效率和特异性,并探索新的方法来减少脱靶效应和染色体易位的风险。此外,我们还可以研究如何将这些工程化的B细胞用于临床应用,例如作为免疫治疗或基因治疗的工具。通过不断改进和探索新的技术,我们有望在不久的将来实现更高效、更安全的人B细胞基因组工程。
| Name | gRNA sequence |
|---|---|
| CD19 | 5’-GCTGTGCTGCAGTGCCTCAA-3’ |
| AAVS1 | 5’-GTCACCAATCCTGTCCCTAG-3’ |
Table 1: gRNA sequences.
| Reagents | Volume per 1 reaction |
|---|---|
| P3 Primary Cell solution | 16.4 mL |
| Supplement 1 | 3.6 mL |
| Total | 20 mL |
Table 2: Preparation of Nucleofection reagent mix.
| Description | Sequence | Purpose |
|---|---|---|
| CD19 forward primers | 5’-AAATTCAGGAAAGGGTTGGAAG-3’ | Amplify the CD19 locus for Indel analysis |
| CD19 Reverse primer | 5’-GCGGACCTCTTCTGTCCATG-3’ | Amplify the CD19 locus for Indel analysis |
| Junction PCR forward primer | 5’-GGACGAGCTGTACAAGTAACG-3’ | Junction PCR |
| Junction PCR Reverse primer | 5’-GAGACAGTGACCAACCATCC-3 | Junction PCR |
Table 3: Primers used.
| Description | Fluorophore | Clone |
|---|---|---|
| Anti-human CD19 | PerCP | HIB19 |
| Viability Dye | eFlour 780 | - |
Table 4: Flow cytometry antibody and viability dye.
References
- LeBien, T. W., Thomas, T. F. B lymphocytes: how they develop and function. Blood. 112 (5), 1570-1580 (2008).
- Nutt, S. L., Hodgkin, P. D., Tarlinton, D. M., Corcoran, L. M. The generation of antibody-secreting plasma cells. Nature Reviews Immunology. 15, 160-171 (2015).
- Slifka, M. K., Antia, R., Whitmire, J. K., Ahmed, R. Humoral immunity due to long-lived plasma cells. Immunity. 8 (3), 363-372 (1998).
- Spriggs, M. K., et al. Recombinant human CD40 ligand stimulates B cell proliferation and immunoglobulin E secretion. Journal of Experimental Medicines. 176 (6), 1543-1550 (1992).
- Fusil, F., et al. A lentiviral vector allowing physiologically regulated membrane-anchored and secreted antibody expression depending on B-cell maturation status. Molecular Therapy. 23 (11), 1734-1747 (2015).
- Luo, X. M., et al. Engineering human hematopoietic stem/progenitor cells to produce a broadly neutralizing anti-HIV antibody after in vitro maturation to human B lymphocytes. Blood. 113 (7), 1422-1431 (2008).
- Mock, U., Thiele, R., Uhde, A., Fehse, B., Horn, S. Efficient lentiviral transduction and transgene expression in primary human B cells. Human Gene Therapy Methods. 23 (6), 408-415 (2012).
- Heltemes-Harris, L. M., et al. Sleeping Beauty transposon screen identifies signaling modules that cooperate with STAT5 activation to induce B-cell acute lymphoblastic leukemia. Oncogene. 35 (26), 3454-3464 (2016).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Cui, Y., Xu, J., Cheng, M., Liao, X., Peng, S. Review of CRISPR/Cas9 sgRNA design tools. Interdisciplinary Sciences. 10 (2), 455-465 (2018).
- Rees, H. A., Liu, D. R. Base editing: precision chemistry on the genome and transcriptome of living cells. Nature Reviews Genetics. 19 (12), 770-788 (2018).
- Spiegel, A., Bachmann, M., Jurado Jiménez, G., Sarov, M. CRISPR/Cas9-based knockout pipeline for reverse genetics in mammalian cell culture. Methods. 164-165, 49-58 (2019).
- Suzuki, T., Kazuki, Y., Oshimura, M., Hara, T. A novel system for simultaneous or sequential integration of multiple gene-loading vectors into a defined site of a human artificial chromosome. PLoS One. 9, 110404 (2014).
- Bak, R. O., Porteus, M. H. CRISPR-mediated integration of large gene cassettes using AAV donor vectors. Cell Reports. 20 (3), 750-756 (2017).
- Shirley, J. L., de Jong, Y. P., Terhorst, C., Herzog, R. W. Immune responses to viral gene therapy vectors. Molecular Therapy. 28 (3), 709-722 (2020).
- Martino, A. T., Markusic, D. M. Immune response mechanisms against AAV vectors in animal models. Molecular Therapy - Methods and Clinical Development. 17, 198-208 (2020).
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/16/使用CRISPR-Cas9的人类B细胞基因组工程/
- 版权声明: 转载请注明出处,谢谢。

