[TOC]
Yohei Katoh ,KN Kentaro Nakamura,KN Kazuhisa Nakayama
第一次发布: 2018年01月05日第8卷第1期 DOI: 10.21769/BioProtoc.2687
评审: Alessandro DidonnaLai-Yee WongMirko Messa
Abstract
可见免疫沉淀(VIP)分析是一种方便的替代传统共免疫沉淀(Katoh et al., 2015)的方法。通过处理共表达GFP融合蛋白和RFP融合蛋白的细胞裂解液,并使用GST标记的抗GFP纳米体和谷胱甘肽-Sepharose珠子进行免疫沉淀,可以在荧光显微镜下直接观察到带有免疫沉淀的珠子,从而可视化蛋白质-蛋白质相互作用。该分析方法可以同时检查大量蛋白质组合,无需包括SDS-PAGE和免疫印迹在内的耗时程序。此外,VIP分析可以检查复杂的单对多和多对多蛋白质相互作用。VIP分析的另一个重要特点是使用纳米体进行免疫沉淀。纳米体是从骆驼科动物(骆驼及其近亲)衍生出的单一域抗体。由于其体积小、高亲和力、高特异性和稳定性,大肠杆菌中表达的抗GFP纳米体可以在大规模上纯化,并几乎无限量地用于免疫沉淀实验。在这里,我们描述了制备GST标记的抗GFP纳米体和VIP分析的协议。
背景介绍:
几乎所有细胞内的蛋白质都是通过与其他蛋白质相互作用来发挥功能的。揭示蛋白质-蛋白质相互作用网络对于理解蛋白质的功能至关重要。已经开发了各种方法来分析蛋白质-蛋白质相互作用,如酵母双杂交系统、GST拉下技术和共免疫沉淀。最近,我们开发了一种新的蛋白质-蛋白质相互作用分析方法,称为可见免疫沉淀(VIP)分析法(Katoh et al., 2015)。VIP分析法最重要的优势在于它方便快捷。该分析法可以在短时间内检查大量蛋白质组合,无需包括SDS-PAGE和免疫印迹在内的耗时程序。此外,VIP分析法能够同时确定两个以上蛋白质之间的相互作用。这个强大的工具可以用来揭示多蛋白质复合物的复杂结构,这是传统蛋白质-蛋白质相互作用分析方法无法确定的。利用VIP分析法的优势,我们阐明了多亚基复合物的结构,包括BBSome(由8个亚基组成)(Katoh et al., 2015)、IFT-B(16个亚基)(Katoh et al., 2016)和IFT-A(6个亚基)(Hirano et al., 2017),这些复合物都涉及在细胞内的蛋白质运输。
材料和试剂
- 10 ml试管(ASIA KIZAI,目录号:2221C010B-10)
- 50 ml试管(Thermo Fisher Scientific,Thermo ScientificTM,目录号:339652)
- 15 ml试管(Thermo Fisher Scientific,Thermo ScientificTM,目录号:339650)
- 6孔板(Thermo Fisher Scientific,Thermo ScientificTM,目录号:140675)
- 1.5 ml试管(BIO-BIK,目录号:RC-0150)
- 0.2 ml 8管条(Greiner Bio One International,目录号:673210和373270)
- 96孔板(Thermo Fisher Scientific,Thermo ScientificTM,目录号:167008)
- 0.22 µm PVDF过滤器(Millex-GV 0.22 µm PVDF 33 mm Gamma灭菌)(Merck,目录号:SLGV033RS)
- pGEX6P1-GFP-Nanobody(Addgene,目录号:61838)
- 大肠杆菌BL21-CodonPlus(DE3)-RIPL株(Agilent Technologies,目录号:230280)
- 人胚胎肾293T细胞(例如,ATCC,目录号:CRL-3216)
- 荧光蛋白表达载体(例如,mEGFP-C1/N1 [Addgene,目录号:54759和54767],pmCherry-C1/N1 [Takara Bio,Clontech,目录号:632524和632523] 或 pTagRFP-C/N [Evrogen,目录号:FP141和FP142]Luria-Bertani (LB)培养基(NACALAI TESQUE,目录号:20068-75)
- LB琼脂平板(NACALAI TESQUE,目录号:20069-65)
- 氨苄青霉素(NACALAI TESQUE,目录号:02739-32)
- 异丙基β-D-1-硫代半乳糖苷(IPTG)(NACALAI TESQUE,目录号:19742-94)
- 聚乙二醇单-p-异辛基苯醚(Triton X-100)(NACALAI TESQUE,目录号:12967-45)
- 谷胱甘肽-Sepharose 4B(GE Healthcare,目录号:17075601)
- 无钙镁磷酸盐缓冲液[PBS(-)](NACALAI TESQUE,目录号:1148215)
- CBB染色剂One Super(NACALAI TESQUE,目录号:11642-31)
- Dulbecco’s改良Eagle培养基(DMEM),高糖(NACALAI TESQUE,目录号:08458-16)
- 胎牛血清(FBS)(Thermo Fisher Scientific,GibcoTM,目录号:10270106)
- Opti-MEM(Thermo Fisher Scientific,目录号:31985070)
- 二硫苏糖醇(DTT)(NACALAI TESQUE,目录号:14112-52)
- 聚乙烯亚胺(PEI Max,Mw 40,000)(Polysciences,目录号:24765-2)
- HEPES(NACALAI TESQUE,目录号:17546-05)
- 氯化钠(NaCl)(NACALAI TESQUE,目录号:31320-05)
- 甘油(NACALAI TESQUE,目录号:17018-25)
- 通用蛋白酶抑制剂 cocktail(100x)(NACALAI TESQUE,目录号:04080-11) 注:此蛋白酶抑制剂 cocktail 包含 4-(2-氨基乙基)苯磺酰氟化氢盐酸盐(AEBSF)、抑肽酶、E-64、硫酸链霉素一水合物,和二钠二氢乙二胺四乙酸二水合物(EDTA)。
- 牛血清白蛋白(BSA)(NACALAI TESQUE,目录号:08587-84)
- 用于哺乳动物细胞和组织提取的蛋白酶抑制剂 cocktail(100x)(NACALAI TESQUE,目录号:25955-11)
注:此蛋白酶抑制剂 cocktail 包含 4-(2-氨基乙基)苯磺酰氟化氢盐酸盐(AEBSF)、抑肽酶、E-64、硫酸链霉素一水合物、苯甲酰苯丙氨酸甲酯和腐胺。 - 结合缓冲液(见配方)
- 洗涤缓冲液(见配方)
- 2 mg/ml PEI Max 试剂(见配方)
- HEPES、NaCl、Triton X-100 和甘油(HNTG)缓冲液(见配方)
设备
多通道移液器(20-200 µl)(Greiner Bio One International,目录号:89008200)
吸管 大型离心机(日立工机,型号:CR22G)
可设置为4 °C的冷却离心机(TOMY SEIKO,型号:EX-136)
台式离心机(Eppendorf,型号:5415 R)
PCR管离心机(BM Equipment,型号:ForceMini)
摇床培养箱(TAITEC,型号:BR-23FP)
旋转器(TAITEC,型号:RT-50)
超声波细胞破碎仪(Misonix,型号:S-4000)
荧光显微镜(Keyence,型号:BZ-8000)
物镜(尼康,PlanApo 20x NA0.75 WD1.00)
500 ml烧瓶(AGC Techno Glass,目录号:4551FK500R)
分光光度计(GE healthcare,型号:UltrospecTM 2100 pro)
光度计比色杯(GE Healthcare,目录号:80-2076-38)
步骤
A. GST标记的抗GFP纳米体的制备
在这里,我们介绍制备GST标记的抗GFP纳米体的方法。在我们的条件下,通常从200 ml的大肠杆菌培养物中纯化约1 mg的蛋白质。
取携带pGEX6P1-GFP-Nanobody的大肠杆菌单菌落,接种到含有50 µg/ml氨苄青霉素的3 ml LB培养基的试管中,并在37 °C下剧烈振荡培养过夜。
- 将2 ml过夜培养物接种到含有50 µg/ml氨苄青霉素的200 ml LB培养基的烧瓶中,并在37 °C下以130 rpm的转速摇动,直到培养物的OD600达到0.5(约需2-4小时)。
- 为了诱导GST标记的抗GFP纳米体的表达,向烧瓶中加入200 µl的100 mM IPTG(最终浓度为0.1 mM),并在30 °C下以130 rpm的转速摇动4小时。
- 将培养物转移到适当的离心管中,并在4 °C下以5,550 x g(例如,在Himac CR22G离心机中以6,000 rpm)的转速离心15分钟。
- 弃去上清液,用10 ml结合缓冲液(见配方)重悬细胞。
- 将细胞悬液转移到50 ml管中,并通过超声波细胞破碎仪进行破碎。在冰上进行5轮超声(15秒开启和15秒关闭),使用30%的振幅。
- 向管中加入0.5 ml的20% Triton X-100水溶液,使最终浓度达到1%,并在4 °C(或冰上)孵育20分钟,以帮助细胞裂解。
- 在4 °C下以20,700 x g(例如,在Himac CR22G离心机中以12,000 rpm)的转速离心20分钟,并将上清液转移到15 ml管中。
- 将上清液分为2 x 5 ml。在这里,我们使用2个试管。
- 向5 ml上清液中加入2.5 ml(床体积)的用PBS(-)平衡的谷胱甘肽-Sepharose 4B珠子,并在4 °C下旋转孵育过夜(12-24小时),使纳米体与珠子结合。
- 在4 °C下以780 x g(例如,在EX-136离心机中以2,000 rpm)的转速离心2分钟,并通过吸管去除上清液。
- 向沉淀中加入10 ml冰冷的洗涤缓冲液(见配方)。
- 重复步骤A10和A11共8次。
- 将珠子保留为1:1的悬浮液,在洗涤缓冲液中(即2.5 ml珠子和2.5 ml洗涤缓冲液)。珠子可以在4 °C下储存几个月。
注意:我们通常将珠子悬浮液分为1 ml(床体积500 µl)的等分。 - 通过SDS-PAGE和考马斯亮蓝(CBB)染色检查纯化GST标记的抗GFP纳米体的质量和数量。在我们的制备条件下,大约1 µg/5 µl(珠子床体积)的纳米体蛋白被纯化。一个典型的结果如图1所示。
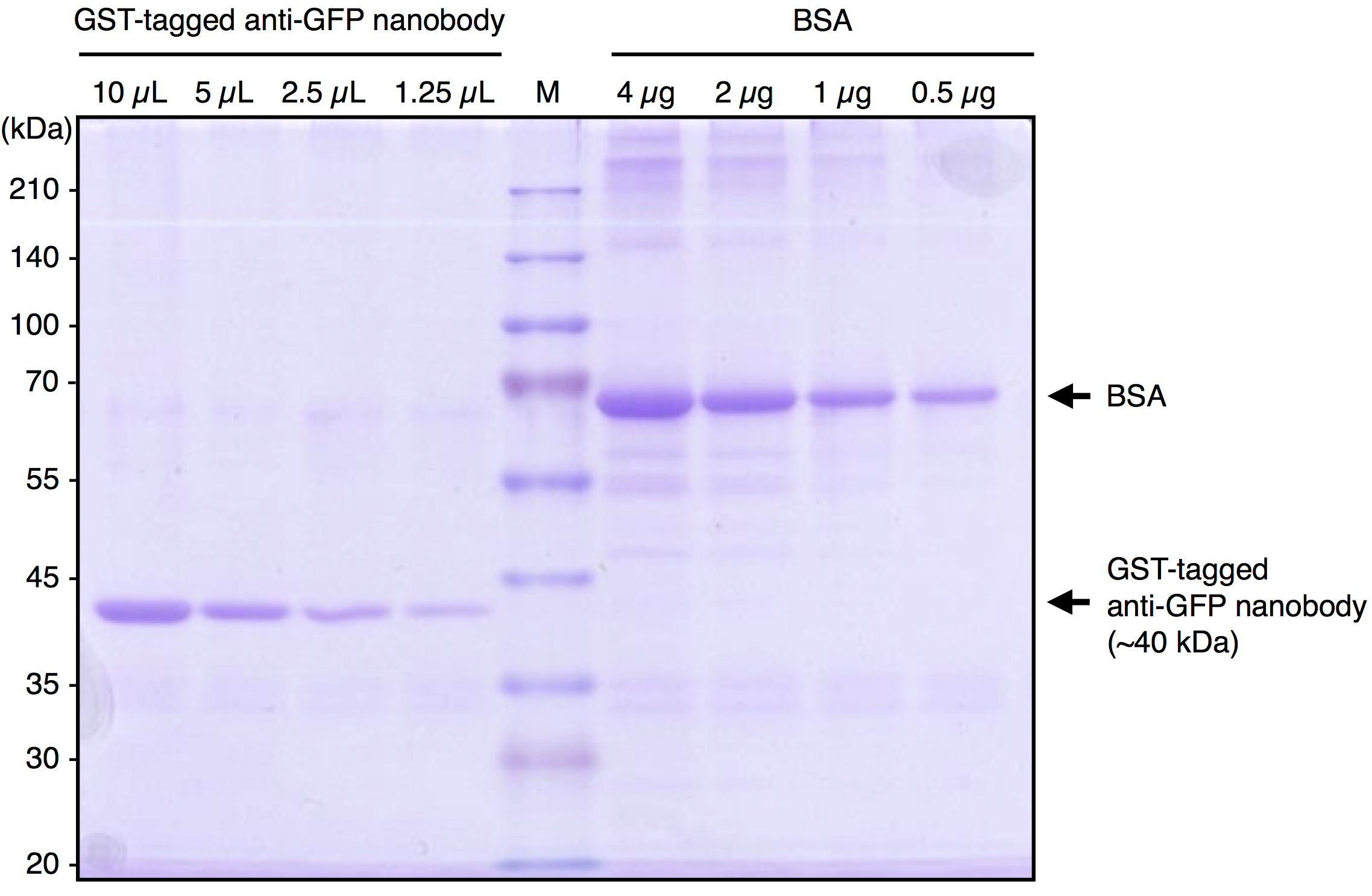
[^图1. 纯化GST标记的抗GFP纳米体的典型结果。]: 纯化的GST标记的抗GFP纳米体和BSA经SDS-PAGE和CBB染色处理。通过比较纯化蛋白的条带强度与BSA的条带强度,估计纯化GST标记的抗GFP纳米体的浓度约为1 μg/5 μl(床体积)。
B. VIP分析法的执行
在这里,我们将介绍如何执行VIP分析法(图2和视频1)。
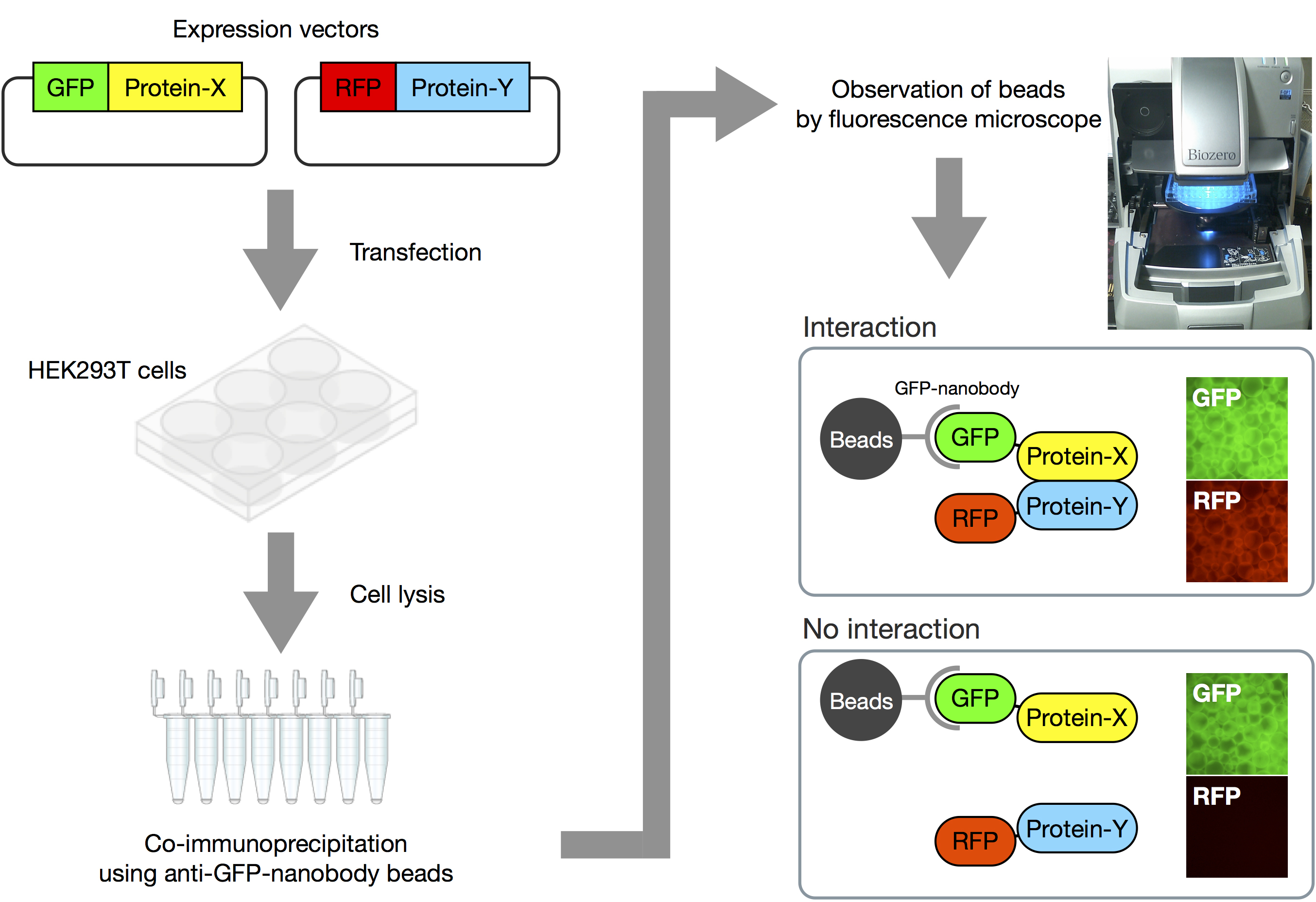
将大约8 × 10^5个HEK293T细胞播种到6孔板中,并在含5% FBS的2 ml DMEM高糖培养基中孵育24小时。
使用PEI Max试剂(见配方)共转染表达GFP融合蛋白和RFP融合蛋白的表达载体。
a. 在一个1.5 ml管中混合250 µl Opti-MEM和4 µg DNA(例如,2 μg GFP表达载体和2 μg RFP表达载体)。
b. 在另一个1.5 ml管中混合250 µl Opti-MEM和10 µl 2 mg/ml的PEI Max试剂,室温下孵育5分钟。
c. 通过涡旋混合DNA溶液和PEI溶液,并在室温下孵育20分钟。
d. 将500 µl的DNA/PEI混合物加入到6孔板中的每个孔中。
24小时后,通过荧光显微镜观察细胞以确认GFP融合蛋白和RFP融合蛋白的表达。
通过吸管完全去除板上的培养基,向每个孔中加入250 µl冰冷的HNTG缓冲液(见配方),并在冰上孵育5-10分钟以脱离贴壁细胞。
通过吸管悬浮细胞,将细胞悬液转移到一个1.5 ml管中,并在冰上孵育15分钟以裂解细胞。
在4 °C以16,100 x g(例如,在5415 R离心机中以13,200 rpm)的转速离心15分钟。
将200 µl上清液转移到含有预先结合到谷胱甘肽-Sepharose珠子上的GST标记的抗GFP纳米体的0.2 ml 8管条中,并在4 °C下用管旋转器持续旋转孵育1小时。
离心8管条30秒,并通过吸管去除上清液。
添加180 µl冰冷的HNTG缓冲液,并通过轻敲8管条混合内容物。
重复步骤B8和B9三次。
最后,将珠子悬浮在180 µl冰冷的PBS(-)中,并将珠子悬浮液转移到96孔板中。
在荧光显微镜下观察珠子上的绿色和红色荧光,并获取图像。为了比较荧光强度,在固定条件下(相机的曝光时间和ISO灵敏度)获取图像。
如果需要进行免疫印迹,收集珠子。
数据分析
VIP分析法的示例
IFT-B复合物负责细胞蛋白运输,这是一个由16个亚基组成的大型蛋白质复合物。我们通过VIP分析法确定了IFT-B亚基之间的二元相互作用以及一对多和多对多的蛋白质相互作用,从而揭示了IFT-B复合物的结构(Katoh et al., 2016)。在这里,我们展示了一些IFT-B亚基的相互作用分析示例。
实验示例1:二元蛋白质相互作用
在带有GFP标签和mCherry(mChe)标签的IFT74和IFT81上执行VIP分析法(图3A)。左侧第四和第五个面板中的红色信号表明IFT74和IFT81相互作用。
实验示例2:一对多蛋白质相互作用
在带有GFP标签的IFT22和带有mChe标签的IFT74、IFT81或IFT74 + IFT81上执行VIP分析法(图3B)。GFP-IFT22没有与mChe-IFT74或mChe-IFT81单独相互作用。然而,GFP-IFT22与带有mChe标签的IFT74 + IFT81异二聚体(图3B右侧面板)相互作用。为了确认IFT74和IFT81都绑定到IFT22,在VIP分析法之后进行了免疫印迹(图3C)。VIP分析法和免疫印迹的结果表明IFT22只与IFT74-IFT81异二聚体相互作用(图3D)。
如上所述,VIP分析法是一种通用且灵活的方法,可以全面检查二元蛋白质相互作用,并检查更复杂的 一对多和多对多蛋白质相互作用。
最后,我们描述VIP分析法的注意事项。在此方法中,使用适当的阳性对照和阴性对照非常重要。作为阳性对照,应使用已知相互作用的蛋白质。作为阴性对照,应仅使用荧光蛋白。使用适当的实验对照有助于确定蛋白质-蛋白质相互作用的阳性或阴性。
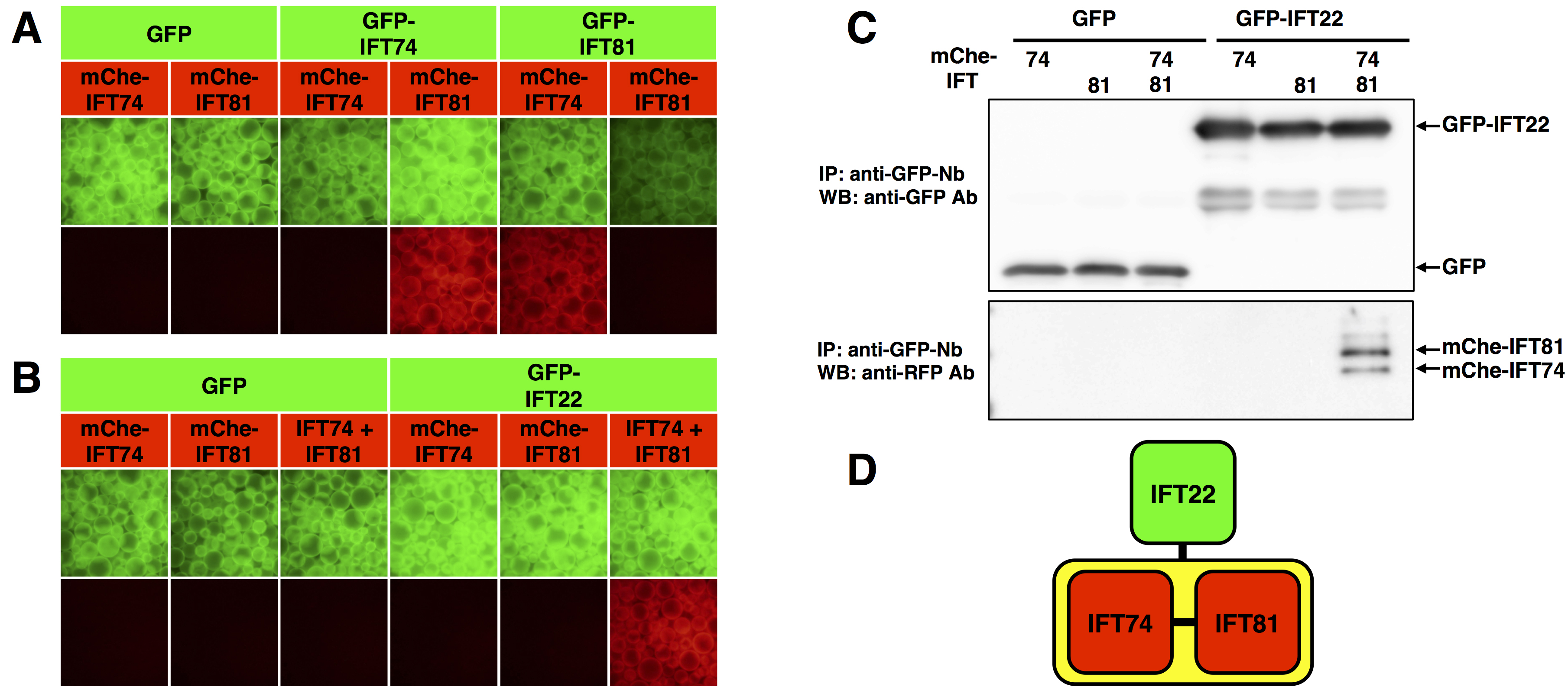
[^图3. VIP分析法揭示的IFT亚基之间的相互作用。]: A. 二元蛋白质相互作用。在GFP或mChe标记的IFT74和IFT81上执行VIP分析法。B. 一对多蛋白质相互作用。在GFP标记的IFT22和mChe标记的IFT74、IFT81或IFT74 + IFT81上执行VIP分析法。C. 在B所示的VIP分析法之后进行了免疫印迹。D. IFT22、IFT74和IFT88的相互作用模式。 (来自Katoh和Nakayama,2017;经YODOSHA Co., Ltd.许可改编。)
配方
- 结合缓冲液
PBS(-)
5 mM DTT
通用蛋白酶抑制剂 cocktail(0.5 mM AEBSF,0.15 µM aprotinin,1 µM E-64,1 µM 硫酸链霉素一水合物,和0.5 mM EDTA) - 洗涤缓冲液
PBS(-)
5 mM DTT
0.1% Triton X-100 - 2 mg/ml PEI Max 试剂
20 mg的PEI Max溶解在10 ml的Milli-Q级水中,通过过滤灭菌
该溶液分为1 ml的等分,可以在4 °C下储存几个月
更长期储存,可以储存在-20 °C - HEPES、NaCl、Triton X-100 和甘油(HNTG)缓冲液
注意:这只是一个裂解缓冲液的例子。也可以使用其他裂解缓冲液进行VIP分析法。
20 mM HEPES(pH7.4)
150 mM NaCl
0.1%(w/v)Triton X-100
10%(w/v)甘油
使用哺乳动物细胞和组织提取的蛋白酶抑制剂 cocktail(1 mM AEBSF,0.8 µM aprotinin,15 µM E-64,20 µM 硫酸链霉素一水合物,50 µM 苯甲酰苯丙氨酸甲酯,和10 µM 腐胺)
References
- Hirano, T., Katoh, Y. and Nakayama, K. (2017). Intraflagellar transport-A complex mediates ciliary entry and retrograde trafficking of ciliary G protein-coupled receptors. Mol Biol Cell 28(3): 429-439.
- Katoh, Y. and Nakayama K. (2017). Visible immunoprecipitation assay: a convenient and versatile method for studying protein‒protein interactions using fluorescent fusion proteins. Experimental Medicine 35: 85-95 (written in Japanese).
- Katoh, Y., Nozaki, S., Hartanto, D., Miyano, R. and Nakayama, K. (2015). Architectures of multisubunit complexes revealed by a visible immunoprecipitation assay using fluorescent fusion proteins. J Cell Sci 128(12): 2351-2362.
- Katoh, Y., Terada, M., Nishijima, Y., Takei, R., Nozaki, S., Hamada, H. and Nakayama, K. (2016). Overall architecture of the Intraflagellar Transport (IFT)-B complex containing Cluap1/IFT38 as an essential component of the IFT-B peripheral subcomplex. J Biol Chem 291: 10962-10975.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/14/蛋白质相互作用可视化检测方法/
- 版权声明: 转载请注明出处,谢谢。

