第一次发布: 2013年09月20日第3卷第18期 DOI: 10.21769/BioProtoc.907
Abstract
诱导多能干细胞(iPS细胞)的生成提供了一个使用患者特异性体细胞的机会,这些细胞是疾病建模和药物发现的重要资源。为了促进这些研究,从易于获取且侵入性较小的组织(如血液)中制备iPS细胞非常重要。在这里,我们描述了从成人外周血生成人iPS细胞的基本方法。在分离单核细胞之后,一组细胞因子的组合刺激了造血干细胞/祖细胞群体的扩张,这是本协议的主要目标。细胞被转导了编码重编程因子的质粒混合物。在大多数情况下,质粒在建立iPS克隆的过程中丢失。
材料和试剂
- 新鲜抗凝血(约10毫升)
- 无钙镁PBS(Nacalai tesque,目录号:14249-95)
- Ficoll-paque Plus(GE Healthcare,目录号:17-1440-02)
- StemSpan H3000(STEMCELL Technologies,目录号:0 9800)
- 重组人白细胞介素-6(100 μg/ml)(PeproTech,目录号:AF-200-06)
- 重组人干细胞因子(SCF)(300 μg/ml)(PeproTech,目录号:AF-300-07)
- 重组人血小板生成素(TPO)(300 μg/ml)(PeproTech,目录号:AF-300-18)
- 重组人Flt3配体(300 μg/ml)(PeproTech,目录号:AF-300-19)
- 重组人白细胞介素-3(10 μg/ml)(PeproTech,目录号:AF-200-03)
- 重组人碱性成纤维细胞生长因子(bFGF)(10 μg/ml)(Wako,目录号:064-04541)
- Amaxa人类CD34+细胞核转染试剂盒(Lonza,目录号:VPA-1003)
- MEF饲养层(Repro Cell,目录号:RCHEFC003)
- Matrigel生长因子减少(BD Biosciences,目录号:356231)
- 灵长类ES细胞培养基(Repro Cell,目录号:RCHEMD001)
- Essential 6(Life Technologies,目录号:A1516401)
- 明胶(Sigma-Aldrich,目录号:G1890)
- Dulbecco改良Eagle培养基(DMEM)高糖含稳定L-谷氨酰胺(Nacalai tesque,目录号:08459-35)
- 胎牛血清(FBS)(Life Technologies,目录号:10437-028)
- 质粒套装2(Life Technologies,目录号:A15960)
- 血液培养基(见配方)
- 质粒混合物(见配方)
- 转染混合物(见配方)
- iPS培养基1(见配方)
- iPS培养基2(见配方)
- 0.1%明胶溶液(见配方)
- MEF培养基(见配方)
设备
- Nucleofector 2b(Lonza,目录号:AAB-1001)
- 6孔组织培养板(BD Biosciences,Falcon®,目录号:353046)
- 15毫升锥形管(BD Biosciences,Falcon®,目录号:352196)
- 50毫升锥形管(BD Biosciences,Falcon®,目录号:352070)
- 37 °C 5% CO2细胞培养箱
- 显微镜
- 离心机
实验步骤:
第0天
培养基准备:
向6孔板的一个孔中加入含有细胞因子的2毫升血液培养基。
在板的其他孔中加入2毫升PBS,以防止培养基过度蒸发,并将板存放在37°C、5% CO2的环境中。
单核细胞纯化:
将10毫升抗凝血(EDTA)中加入10毫升PBS。
在两个15毫升管中,分别加入5毫升Ficoll-Paque,然后轻轻加入10毫升血+PBS。
在18°C下以400 x g离心30分钟,使用慢加速和慢刹车。
小心移除上清液(约2毫升)的上层部分,不要破坏界面处的单核细胞。
将界面处的细胞(1-2毫升)转移到一个15毫升管中,与12毫升PBS混合均匀。
在18°C下以200 x g离心10分钟(使用慢刹车)。
用3毫升H3000培养基重悬细胞,并计数细胞。
准备3 x 106细胞的1.5毫升管分装。
在18°C下以200 x g离心10分钟(使用慢刹车)。
弃去上清液。
铺板:
将细胞悬浮在步骤1中制备的培养基中。
将板存放在37°C、5% CO2的环境中,约6天。此培养期间不需要更换培养基。
第5天
明胶涂层:
向6孔板每个孔中加入1毫升0.1%明胶溶液。
在37°C下孵育至少半小时。
MEF饲养层细胞准备:
在37°C下解冻MEF饲养层细胞,并计数细胞数量。
弃去上述准备中多余的明胶溶液。
在MEF培养基中将MEF饲养层细胞以每孔3 x 105细胞播种。
第6天
培养基准备:
从MEF饲养层细胞中吸出培养基。
向板中每个孔中加入2毫升含有细胞因子的血液培养基。
收获培养细胞:
将细胞悬浮在培养基中并计数细胞。活细胞数量通常约为1 x 106。
将悬浮细胞收集到15毫升管中。
在18°C下以200 x g离心10分钟(使用慢刹车)。在离心过程中,准备转染混合物。
核转染:
用手持移液器完全吸出细胞的上清液。
加入转染混合物并悬浮细胞,小心不要产生气泡。
使用程序U-008进行核转染。
铺板,每孔105至104细胞:
在核转染后立即向电穿孔杯中加入800微升H3000,收获细胞。核转染溶液中的金属离子对细胞有毒!
将细胞铺到MEF饲养层板上,每孔从5 x 105细胞到5 x 104细胞不等。
第8、10和12天
每孔添加额外的1.5毫升iPS培养基1。不要吸出现有的培养基。
第14天及以后
用1.5毫升iPS培养基1替换培养基。* 培养基更换每2天进行一次。
第25至35天
挑选直径约2毫米的克隆。
Notes:
可以使用冷冻的外周血单个核细胞(PBMC)与此协议配合使用。在第0天,直接在血液培养基中培养解冻的PBMC。
iPS细胞可以在无饲养层条件下建立,但效率较低。对于无饲养层条件,使用Matrigel涂层的板和iPS培养基2代替MEF饲养层和iPS培养基1。以下是制作Matrigel涂层板的步骤:
在4°C下解冻Matrigel,并将其稀释至在6毫升冷却的DMEM中相当于2毫克蛋白质的浓度。
将1毫升/孔的溶液添加到6孔板中。
在室温下储存1小时。
在播种细胞之前,用PBS清洗板一次。
配方
血液培养基
StemSpan H3000,包含以下细胞因子:
- 10 ng/ml IL-3
- 100 ng/ml IL-6
- 300 ng/ml SCF
- 300 ng/ml TPO
- 300 ng/ml Flt3配体
- 使用后立即使用
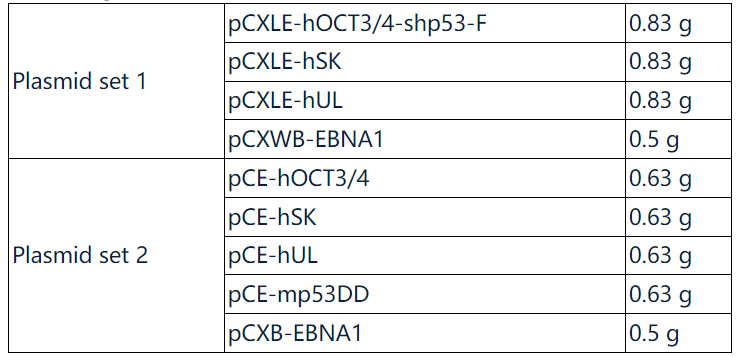
质粒混合物(Addgene,http://www.addgene.org/Shinya_Yamanaka)
使用以下质粒混合物。Set 1显示出更高的效率。在Set 2中,我们省略了WPRE序列,并用针对p53的shRNA替换了小鼠p53的显性负形式,该显性负形式存在于Set 1中。存放在-20°C。Set 2可以从Life Technologies购买。
 **转染混合物**
Amaxa CD34溶液
81.8 μl
补充剂
18.2 μl
质粒混合物(Set 1或2)
3 μl(3 μg)
使用后立即使用
**iPS培养基1**
灵长类ES细胞培养基,含4 ng/ml bFGF
存放在4°C,暗处一周
**iPS培养基2**
Essential 6,含100 ng/ml bFGF
存放在4°C,暗处一周
**0.1%(w/v)明胶溶液**
将1克明胶粉末溶解在100毫升去离子水中(1% w/v,10倍浓度),高压灭菌后存放在4°C。
为了制备0.1%(1x)明胶溶液,将10倍明胶储备液在37°C下加热,然后将其中的50毫升加入到450毫升去离子水中。使用瓶盖过滤器(0.22 μm)过滤溶液,并存放在4°C。
**MEF培养基**
含10% FBS的DMEM
请注意,这里的专业术语已经尽量翻译成对应的中文,但对于某些特定产品名称和型号,保留了原英文名称以确保准确性。
**转染混合物**
Amaxa CD34溶液
81.8 μl
补充剂
18.2 μl
质粒混合物(Set 1或2)
3 μl(3 μg)
使用后立即使用
**iPS培养基1**
灵长类ES细胞培养基,含4 ng/ml bFGF
存放在4°C,暗处一周
**iPS培养基2**
Essential 6,含100 ng/ml bFGF
存放在4°C,暗处一周
**0.1%(w/v)明胶溶液**
将1克明胶粉末溶解在100毫升去离子水中(1% w/v,10倍浓度),高压灭菌后存放在4°C。
为了制备0.1%(1x)明胶溶液,将10倍明胶储备液在37°C下加热,然后将其中的50毫升加入到450毫升去离子水中。使用瓶盖过滤器(0.22 μm)过滤溶液,并存放在4°C。
**MEF培养基**
含10% FBS的DMEM
请注意,这里的专业术语已经尽量翻译成对应的中文,但对于某些特定产品名称和型号,保留了原英文名称以确保准确性。
References
- Mack, A. A., Kroboth, S., Rajesh, D. and Wang, W. B. (2011). Generation of induced pluripotent stem cells from CD34+ cells across blood drawn from multiple donors with non-integrating episomal vectors. PLoS One 6(11): e27956.
- Okita, K., Matsumura, Y., Sato, Y., Okada, A., Morizane, A., Okamoto, S., Hong, H., Nakagawa, M., Tanabe, K., Tezuka, K., Shibata, T., Kunisada, T., Takahashi, M., Takahashi, J., Saji, H. and Yamanaka, S. (2011). A more efficient method to generate integration-free human iPS cells. Nat Methods 8(5): 409-412.
- Okita, K., Yamakawa, T., Matsumura, Y., Sato, Y., Amano, N., Watanabe, A., Goshima, N. and Yamanaka, S. (2013). An efficient nonviral method to generate integration‐free human‐induced pluripotent stem cells from cord blood and peripheral blood cells. Stem Cells 31(3): 458-466.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/14/用人外周血液中的非T淋巴细胞、B细胞诱导生成全能干细胞/
- 版权声明: 转载请注明出处,谢谢。

