MC Man Chun Chiu,CL Cun Li,YY Yifei Yu,XL Xiaojuan Liu,JH Jingjing Huang,ZW Zhixin Wan,
首次发布: 2023年04月20日第13卷第8期 DOI: 10.21769/BioProtoc.4657
评审: Vivien Jane Coulson-ThomasSudhir Verma 匿名评审
My Notes:
主要工作:
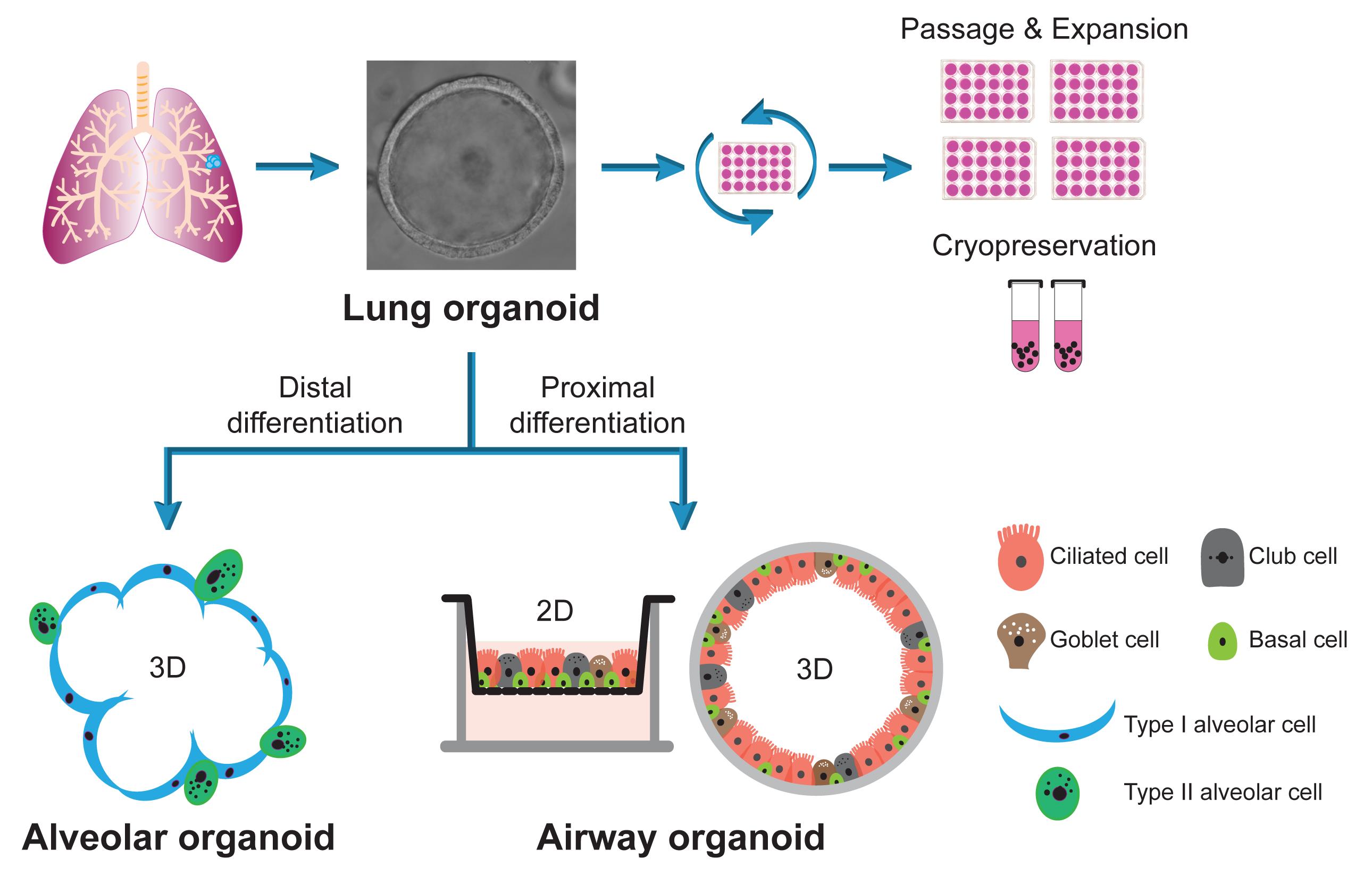
双潜能人肺类器官培养系统的建立:通过从患者肺组织分离细胞,在基底培养基中培养,生成双潜能人肺类器官,并能在扩张培养基中长期稳定传代。
分化产生肺泡类器官:将肺类器官机械剪碎成单细胞,然后在肺泡分化培养基中悬浮培养,经过10-14天分化成熟,得到肺泡类器官。
优化气道类器官的生成:将肺类器官机械剪碎成单细胞,种植在Transwell小室上室,经过近2周分化,得到优化的气道类器官。
类器官的表征:通过RT-qPCR、免疫荧光、流式细胞术、电镜等方法,对类器官的基因和蛋白表达进行检测,以验证其与人体肺组织的相似性。
双潜能人肺类器官培养系统的意义:该系统实现了对呼吸道上皮细胞的长期扩增和双向分化,为研究人体呼吸系统的生物学和病理学提供了独特的活体模型。
Abstract
一个健壮的人体呼吸上皮体外模型,包括肺泡和气道上皮,对于理解人体呼吸系统的生物学和病理学至关重要。研究人员之前描述了一种从原发性肺组织中衍生出人肺器官团的协议。现在,研究人员描述了一种诱导双向分化的协议,以生成成熟的肺泡或气道器官团。肺器官团在连续扩展超过一年的时间里具有高稳定性,而分化的肺泡和气道器官团在形态和功能上模拟人体肺泡和气道上皮,接近生理水平。因此,研究人员建立了一个完整的人体呼吸上皮的健壮器官团培养系统,这是第一个允许长期扩展和双向分化呼吸上皮细胞的二阶段双向潜能器官团培养系统。长期可扩展的肺器官团和分化的器官团产生了一个稳定和可再生的呼吸上皮细胞来源,使科学家能够在培养皿中重建和扩展人体呼吸上皮。呼吸器官团系统提供了一个独特且生理活跃的人体呼吸上皮体外模型,适用于各种应用,包括研究呼吸道病毒感染、疾病建模、药物筛选和临床前测试。
近期干细胞技术的进步使得生成迷你器官或称为类器官的三维细胞培养物成为可能。根据定义,类器官是由干细胞衍生而来的三维培养物;它们模拟了相应组织或器官在体内的结构和功能(Lancaster和Knoblich,2014;李明和李普索·贝尔蒙特,2019;Schutgens和Clevers,2020)。类器官已经成为模拟发育生物学、生理学和病理学的强大和创新工具。
类器官可以由多能干细胞或成人干细胞(ASC)衍生。当提供适当的生态位因子时,从组织中分离出的ASC可以自我更新和自我组织成由多种组织特异性细胞类型组成的类似器官的多细胞簇,其形态和功能模拟体内的对应物。第一个ASC衍生的类器官——人类肠道类器官的生成,是在2009年报道的(Sato等人,2009和2011)。此后,为多种人类器官和组织建立了ASC衍生的类器官,包括前列腺(Chua等人,2014;Karthaus等人,2014)、肝脏(Huch等人,2013b;胡等人,2018)、胃(Wroblewski等人,2015;Schlaermann等人,2016)、胰腺(Huch等人,2013a)、乳腺(Sachs等人,2018)和肺(周等人,2018;Sachs等人,2019)。这些ASC衍生的类器官保留了原生器官的基本细胞、结构和功能特性,并在长期培养中保持基因型和表型的稳定性。
人类呼吸道内衬有两种不同的上皮组织:气道和肺泡上皮组织。研究人员与Clevers实验室合作,从肺部组织中建立了可长期扩展的ASC衍生的类肺器官(周等人,2018;Sachs等人,2019)。研究人员进一步开发了一种近端分化协议,并生成了在形态和功能上几乎生理水平模拟气道上皮的3D和2D气道类器官(周等人,2018)。最近发表了一篇详细描述肺类器官的衍生和分化气道类器官生成的协议(李晨等人,2022)。然而,从肺类器官中衍生出由1型和2型肺泡上皮细胞(分别为AT1和AT2)组成的肺泡上皮组织仍然是一个难题。
研究人员最近报道了一种双潜能肺类器官培养系统,可以生成气道和肺泡上皮细胞(Chiu等人,2022)。在这里,研究人员提供了一个从长期扩展的人类肺类器官生成3D肺泡类器官的详细协议,这与之前报道的生成气道类器官的来源相同。研究人员还描述了一个从肺类器官生成优化的2D气道类器官的协议,这更有利于模拟气道上皮。总的来说,研究人员建立了一个双潜能肺类器官培养系统,该系统可以在远端分化时向肺泡类器官双向分化,或在近端分化时向气道类器官分化。肺类器官作为长期扩展的稳定来源,而分化的气道和肺泡类器官分别忠实地模拟了人类气道和肺泡上皮。这些类器官是强大且生理上活跃的工具,适用于各种实验操作,探索人类肺部的生物学和病理学。
Materials and Reagents
实验步骤:
A. 肺类器官的衍生和扩增
1.准备
a. 准备基础培养基(配方1)并保存在冰上或4°C。
b. 准备扩展培养基(配方2)并在37°C下预热。
c. 在4°C下解冻Matrigel,并保存在冰上。注意:Matrigel在室温下会凝固。
d. 在标准细胞培养孵化器中预热24孔悬浮培养板,该孵化器具有5% CO2和湿润气氛,温度为37°C。
e. 通过在火焰(如本生灯)上燃烧,准备开口较窄(≤1 mm)的玻璃巴斯德吸管。将开口从约1.5 mm缩小到≤1 mm。使巴斯德吸管冷却。使用前对巴斯德吸管进行高压灭菌。
注意:燃烧过程还旨在使玻璃吸管的边缘平滑,减少细胞损伤。可以使用任何开口较窄(≤1 mm)且边缘平滑的细尖巴斯德吸管。
f. 在将巴斯德吸管用于机械剪切类器官(即步骤A3e和B2e)之前,用基础培养基2-3 mL冲洗巴斯德吸管几次上下,以避免细胞过度附着。
2. 肺类器官的衍生
a. 从因各种疾病接受手术的患者那里获取新鲜切除的肺部组织。将组织在冷基础培养基(最好在4°C的冰上)中运输,并在可能的情况下尽快处理。
注意:肺部组织/活检应从远端肺部区域切除,应包含与病变组织相邻的正常组织(具有支气管和肺泡),且直径应为约0.5 cm。
b. 用无菌手术刀在100毫米细胞培养皿中将组织切成小块(≤1毫米)。用10毫升冷基础培养基洗涤组织块,并转移到15毫升离心管中。在4°C下以400 × g离心5分钟。弃去上清。
c. 将组织块在含胶原酶的冷基础培养基中重悬,胶原酶的最终浓度为2毫克/毫升。在摇床上以120转/分钟的温度消化组织块30-40分钟,温度为37°C。
d. 通过上下抽吸20次,使用10毫升血清移液管剪切消化后的组织块。通过100微米细胞过滤器过滤细胞悬液。
e.(可选)用冷基础培养基从细胞过滤器中回收剩余组织块,转移到15毫升离心管中,进行第二轮机械剪切抽吸,然后过滤以增加细胞产量。
f. 向过滤液中添加FBS,最终浓度为2%,以终止酶消化。在4°C下以400 × g离心5分钟。弃去上清。
g.(可选)将沉淀物在2毫升红细胞裂解缓冲液中重新悬浮,并在室温下孵育5分钟以去除红细胞。
h. 用10毫升冷基础培养基洗涤细胞。在4°C下以400 × g离心5分钟。弃去上清。
i. 将沉淀物悬浮在冷Matrigel中。对于来自直径约0.5厘米的肺部组织的细胞,加入80-160微Matrigel。将40微升细胞悬液分配到预热的24孔悬浮培养板的每个孔中,并在标准细胞培养CO2孵化器中孵育10-15分钟,让Matrigel滴固化。
j. 向每个孔中加入500微升扩展培养基,并将培养板放入标准细胞培养CO2孵化器中。每2-3天小心更换培养基,不要破坏Matrigel滴。定期在光镜下观察类器官并监测其生长(图1)。
注意:在初始培养中,存在非上皮细胞类型,如肺成纤维细胞,这些细胞将在经过2-3代培养后逐渐消失。
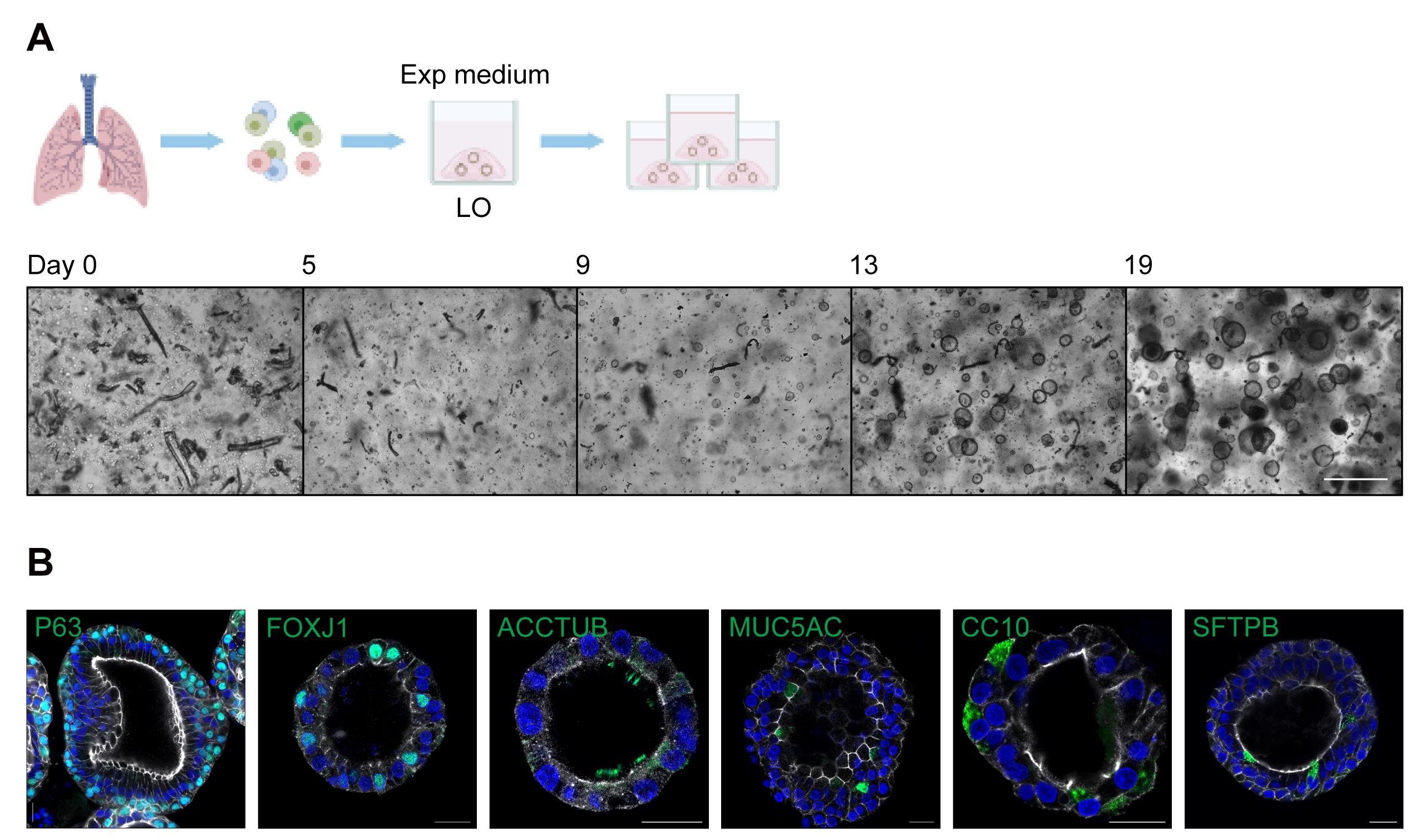
[^图1. 肺类器官的衍生和扩增。]: (A). 上方,一个示意图描绘了在扩展培养基(Exp medium)中肺类器官(LO)的衍生和扩增。下方,光镜图像显示了从分离的肺细胞衍生出的肺类器官在0天、5天、9天、13天和19天的生长情况。比例尺 = 500 μm。 (B). 肺类器官进行了免疫荧光染色,标记P63+基底细胞、FOXJ1+/ACCTUB+纤毛细胞、MUC5AC+杯状细胞、CC10+球形细胞和SFTPB+ AT2细胞(绿色)。细胞核和肌动蛋白丝分别用DAPI(蓝色)和Phalloidin-647(白色)进行复染色。比例尺 = 20 μm。
3. 肺类器官的扩增
a. 每2-3周传代一次肺类器官。
b. 用1,000 μL的移液管上下抽吸培养基10次以破坏Matrigel滴。将混合物转移到15毫升管中。如果收集多个孔中的类器官进行传代,则用冷基础培养基补至总体积10毫升。在冰上孵育混合物5分钟。在4°C下以400 × g离心5分钟。弃去上清。
c. 用冷基础培养基洗涤类器官一次。在4°C下以400 × g离心5分钟。弃去上清。
d.(可选)将类器官在10× TrypLE中悬浮,浓度为1-2毫升,并在37°C下孵育5分钟以消化类器官。向类器官中添加FBS,使最终浓度为2%,以终止酶消化(即对于1毫升10× TrypLE添加20微升FBS)。
注意:当机械剪切方法不足以将肺类器官剪切成小片或类器官大小变化很大时,特别是在后续实验需要相对均匀大小的类器官时,胰蛋白酶消化是首选。
e.使用Pasteur移液管上下抽吸20-40次,将类器官剪切成单个细胞和小细胞团。
f.在光镜下检查剪切的类器官,确保类器官碎片足够小(例如,少于10个细胞)。如有必要,重复机械剪切。
g.用冷基础培养基洗涤细胞。在4°C下以400 × g离心5分钟。弃去上清。
h.根据原始培养中类器官的密度和传代方法,将沉淀物悬浮在估计量的冷Matrigel中,以便以1:2至1:10的比例传代类器官。研究人员通常在机械剪切传代时应用1:2至1:4的比例,而在酶消化传代时应用1:6至1:10的比例。
注意:每个40微升Matrigel中细胞密度应约为2 × 10^–4 × 10^4个细胞。
i.将40微升细胞悬液分配到预热的24孔悬浮培养板的每个孔中,并在标准细胞培养CO2孵化器中孵育10-15分钟,让Matrigel滴固化。
j.向每个孔中加入500微升扩展培养基,并将培养板放入标准细胞培养CO2孵化器中。每2-3天小心更换培养基,不要破坏Matrigel滴。
注意:肺类器官可以每2-3周传代一次,大约持续一年(即16-24次传代)。
B. 肺类器官向肺泡类器官的分化
1.准备
准备远端分化培养基(DD培养基)(配方3)并在37°C下预热。
2. 远端分化悬浮培养
a.在扩展培养基中培养肺类器官12-14天,以准备足够数量的类器官进行分化培养(来自步骤A3j的肺类器官)。
b.用1,000 μL的移液管上下抽吸培养基10次以破坏Matrigel滴。将混合物转移到15毫升管中。如果收集多个孔中的类器官进行传代,则用冷基础培养基补至总体积10毫升。在冰上孵育混合物5-10分钟。在4°C下以400 × g离心5分钟。弃去上清。
注意:使用冷基础培养基(保存在冰上)洗涤类器官并在冰上孵育,以完全去除Matrigel。残留的Matrigel可能会影响后续悬浮培养的效果。
c.用冷基础培养基洗涤类器官。在4°C下以400 × g离心5分钟。弃去上清。
d.将类器官在10× TrypLE中悬浮,浓度/密度为1-2毫升,并在37°C下孵育5分钟以消化类器官。向类器官中添加FBS,使最终浓度为2%,以终止酶消化(即对于1毫升10× TrypLE添加20微升FBS)。
e.使用Pasteur移液管上下抽吸20-40次,将类器官剪切成单个细胞。
f.在光镜下检查以确保类器官被剪切成单个细胞。如有必要,重复机械剪切。
g.用10毫升冷基础培养基洗涤细胞。通过40微米细胞过滤器过滤细胞悬液。在4°C下以400 × g离心5分钟。弃去上清。
h.根据估计的细胞数量,将沉淀物悬浮在1-10毫升远端分化培养基(DD培养基)中。在显微镜下用血细胞计数器计数细胞。用DD培养基将细胞浓度调整至每毫升2 × 10^5个细胞。
i.将500微升细胞悬液(1 × 10^5个细胞)分配到Nunclon Sphera 24孔悬浮培养板的每个孔中。
注意:
1)生成24孔格式中的肺泡类器官,大约需要2.4 × 106个细胞。
2)在悬浮培养中,不要在每个孔中放入太多细胞,因为如果密度过高,细胞可能会形成团块,这可能会影响肺泡分化。
3)在进行移液操作时,避免刮伤培养板底部,因为Nunclon Sphera培养板的超低细胞附着表面可能因此受损。
j.在标准细胞培养孵化器中培养细胞10-14天以成熟(图2)。每隔一天直接向每个孔中添加100微升DD培养基,不需移除旧培养基,因为蒸发会在培养过程中减少培养基的体积。在将板放回孵化器之前,轻轻摇动均匀分布细胞。
注意:
1)确保均匀分布细胞;如果细胞在孔中紧密排列,它们可能会形成团块,这可能会影响肺泡分化。
2)在DD培养基中悬浮培养3-4天后,可以在显微镜下观察到具有腔体和薄壁的类器官。经过10天的远端分化培养,肺泡类器官已经足够成熟,可以模拟原生肺泡上皮,适用于后续的实验操作。
3)薄而平坦的AT1细胞很脆弱。在分化培养和下游过程中,轻轻移液以避免打扰AT1细胞的形态。
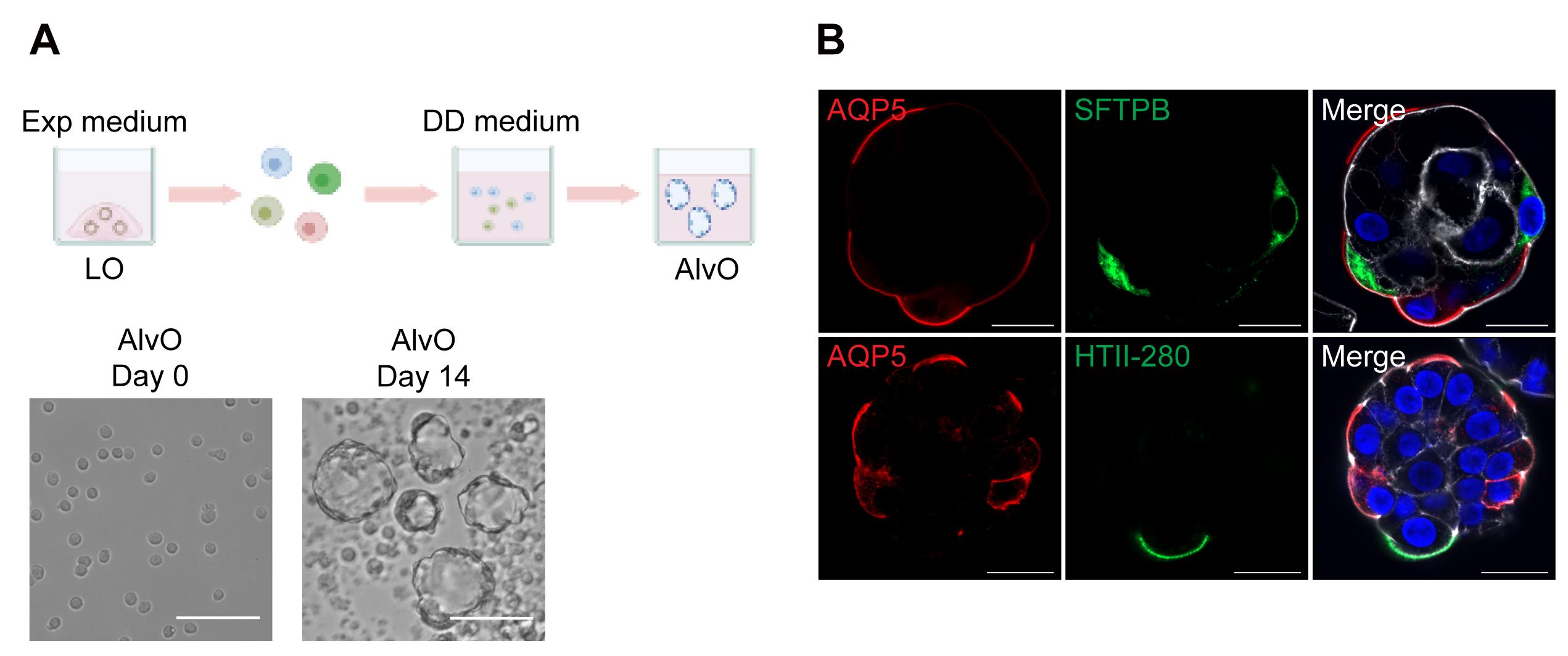
[^图2. 肺泡类器官的生成。]: (A). 上方,一个示意图描绘了使用远端分化培养基(DD培养基)生成肺泡类器官(AlvO)的远端分化协议。Exp medium = 扩展培养基。下方,图像显示了第0天的单细胞悬液和第14天的成熟肺泡类器官。比例尺 = 100 μm。 (B). 肺泡类器官进行了免疫荧光染色,标记AQP5+ AT1细胞(红色)和SFTPB+/HTII-280+ AT2细胞(绿色)。细胞核和肌动蛋白丝分别用DAPI(蓝色)和Phalloidin-647(白色)进行复染色。比例尺 = 20 μm。
C. 近端分化肺类器官以生成优化的2D气道类器官
1.准备
a.准备近端分化培养基(PD培养基)(配方4,不含PIPES,pH 7.4)并在37°C下预热。
b.准备近端分化培养基(PD培养基)(配方4,含PIPES,pH 6.6)并在37°C下预热。
c.在标准细胞培养孵化器中,用基础培养基预孵化Transwell插入物过夜。对于24孔插入物,分别在顶部和底部室中加入200和500微升基础培养基。
2.Transwell插入物中的近端分化
a.在传代后,用扩展培养基培养肺类器官12-14天,以准备足够的细胞进行分化培养(来自步骤A3j的肺类器官)。
b.根据步骤B2b-B2g将肺类器官解聚为单个细胞。
c.根据细胞数量,将沉淀物悬浮在1-4毫升扩展培养基中。用血细胞计数器计数细胞。用扩展培养基将细胞浓度调整至每毫升1.3 × 10^6个细胞。
d.从预孵化Transwell插入物的顶部和底部室中移除基础培养基。将100微升细胞悬液(1.3 × 10^5个细胞)播种到24孔插入物的顶部室中。向底部室中加入500微升扩展培养基。在标准细胞培养CO2孵化器中培养细胞两天,让细胞生长并附着。
注意:为了在24孔Transwell插入物中生成一片2D气道类器官,大约需要3.12 × 10^6个细胞。
e.用PD培养基(pH 7.4)替换顶部和底部室中的扩展培养基。在标准细胞培养CO2孵化器中培养细胞两天,让细胞达到融合。
注意:2D类器官在从扩展培养基更换为PD培养基(pH 7.4)后2-3天达到融合。
f.将PD培养基pH 7.4替换为PD培养基pH 6.6(即顶部和底部室中的pH为6.6/7.4)。在标准细胞培养CO2孵化器中培养细胞10天以成熟(图3)。每2-3天补充PD培养基pH 6.6到顶部室和PD培养基pH 7.4到底部室。
注意:在光镜下,从PD培养基分化第7天开始,通常可以在类器官中观察到摆动的有鞭毛。经过14天的近端分化培养,2D气道类器官已可以准备进行后续实验操作了。
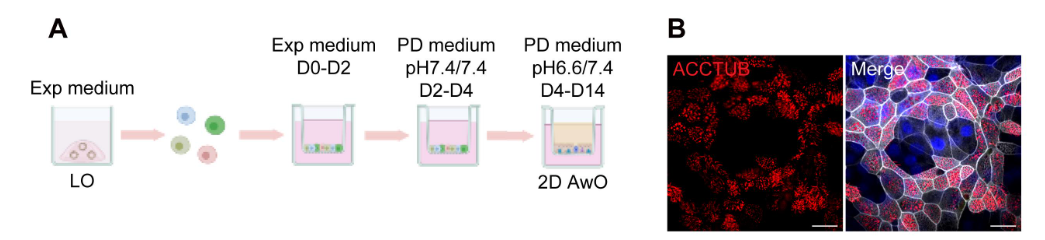
[^图3. 生成优化的2D气道类器官。]: (A). 一个示意图描绘了使用不同pH的近端分化培养基(PD培养基)生成2D气道类器官(AwO)的近端分化协议。Exp medium = 扩展培养基。 (B). 2D优化的气道类器官进行了免疫荧光染色,标记ACCTUB+纤毛细胞(红色)。细胞核和肌动蛋白丝分别用DAPI(蓝色)和Phalloidin-647(白色)进行复染色。比例尺 = 20 μm。
D. 类器官的特征鉴定
1.检查特定细胞类型基因或其他细胞基因的mRNA表达
RT-qPCR检测:向类器官中加入350微升细胞裂解缓冲液进行RNA提取、反转录,并检测细胞基因表达。
注意:使用自体未分化的肺类器官作为比较/对照。
2. 评估特定细胞类型标志物和其他细胞蛋白质的表达
a. 免疫荧光染色和成像
i. 用1毫升4% PFA在室温下固定类器官60分钟。移除PFA,并用2% FBS/PBS洗涤类器官一次。
ii. 用1毫升0.1% Triton X-100在室温下通透类器官10分钟。移除Triton X-100,并用2% FBS/PBS洗涤类器官一次。
iii. 用1毫升3% BSA在室温下封闭类器官60分钟。移除BSA(无需洗涤)。
iv. 将类器官与稀释在2% FBS/PBS中的一抗在4°C下孵育过夜。移除抗体,并用2% FBS/PBS洗涤五次。
注意:参考产品说明书获取抗体的最佳稀释度。
v. 将类器官与稀释在2% FBS/PBS中的二抗在4°C下孵育过夜。移除抗体,并用2% FBS/PBS洗涤五次。
注意:在添加荧光材料(即二抗)后避免暴露于光。
vi. 用2% FBS/PBS稀释的DAPI和Phalloidin在4°C下孵育过夜,进行复染色。移除染料,并用2% FBS/PBS洗涤类器官一次。
vii. 使用Prolong玻璃防褪色封片剂将类器官放置在玻璃载玻片上,并盖上盖玻片,进行共聚焦成像。
注意:玻璃载玻片可在4°C的黑暗中保存约1-2周。
b. 流式细胞术分析
i. 在37°C下用10 mM EDTA处理类器官30-60分钟。
ii. 使用Pasteur移液管上下抽吸20-40次,将类器官剪切成单个细胞。
iii. 用1毫升4% PFA在室温下固定细胞15-30分钟。移除PFA,并用2% FBS/PBS洗涤细胞一次。
iv. 用1毫升0.1% Triton X-100在4°C下通透细胞5分钟。移除Triton X-100,并用2% FBS/PBS洗涤细胞一次。
v. 将细胞与稀释在2% FBS/PBS中的一抗在4°C下孵育60分钟。移除抗体,并用2% FBS/PBS洗涤细胞一次。
注意:参考产品说明书获取抗体的最佳稀释度。
vi. 将细胞与稀释在2% FBS/PBS中的二抗在4°C下孵育60分钟。移除抗体,并用2% FBS/PBS洗涤细胞一次。
注意:在添加荧光材料(即二抗)后避免暴露于光。
vii. 将细胞以每毫升1 × 106细胞的密度悬浮在2% FBS/PBS中,并转移到5毫升圆底聚苯乙烯流式管中,进行流式细胞术分析。
3.其他
a. 电子显微镜(EM)成像:
使用1毫升2.5%戊二醛过夜固定类器官,随后进行电子显微镜处理(切片和染色)以进行超微结构成像。
注意:请参考香港大学电子显微镜单位提供的详细协议(https://emunit.hku.hk/documents/SamplePreparationTechnique.pdf)。
b. 活细胞染色和成像以评估肺泡类器官中AT2细胞的功能:
i. 将肺泡类器官悬浮在0.5毫升添加了1 μM β-BODIPYTM FL C12-HPC的DD培养基中。在标准细胞培养孵化器中以37°C孵育过夜。
注意:避免在添加荧光材料后暴露于光。
ii. 将肺泡类器官收集到15毫升离心管中。用10毫升基础培养基洗涤类器官。在300 × g下离心5分钟。弃去上清。
iii. 将类器官悬浮在0.5毫升添加了100 nM LysoTracker红色素的DD培养基中。在室温下孵育30分钟。
iv. 重复洗涤(步骤D3b.ii)。
v. 将活体类器官放置在玻璃载玻片上,立即进行共聚焦成像。
注意:
所有程序均在生物安全柜中进行。
来自不同供体的类器官可能由于个体基因型和表型差异(例如,基因、年龄、健康状况)而存在一定程度的变异。肺类器官可以冷冻保存以进行长期存储和生物样本库管理。
条件培养基(Rspondin1、Noggin和WNT3A)可以用市售的重组蛋白替代。
扩展和分化培养基(配方2-4)如果适当存储在4°C,可以使用大约2-4周。为了获得最佳性能,请制备新鲜培养基。
试剂配方:
1.基础培养基
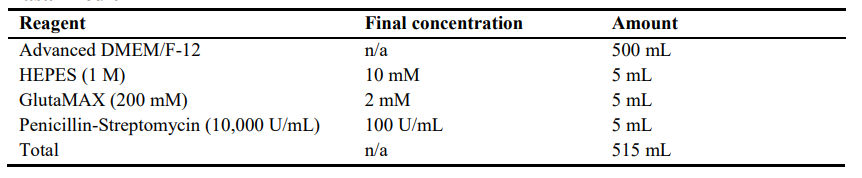
2.扩展培养基
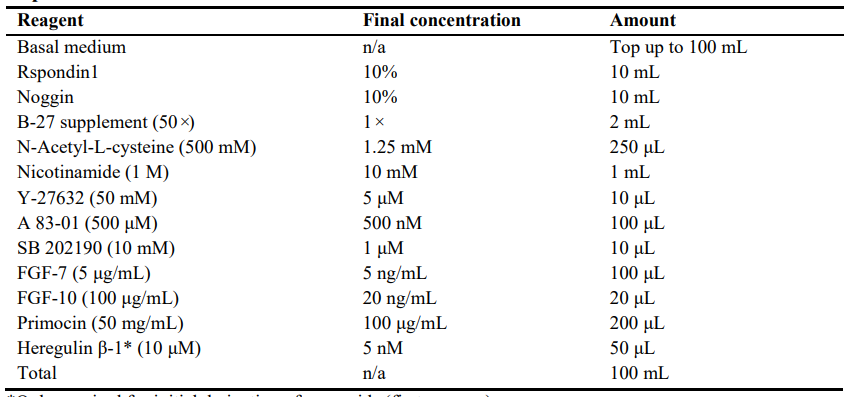
注意:仅适用于类器官的初始衍生(第一次传代)*
3.远端分化培养基(DD培养基)
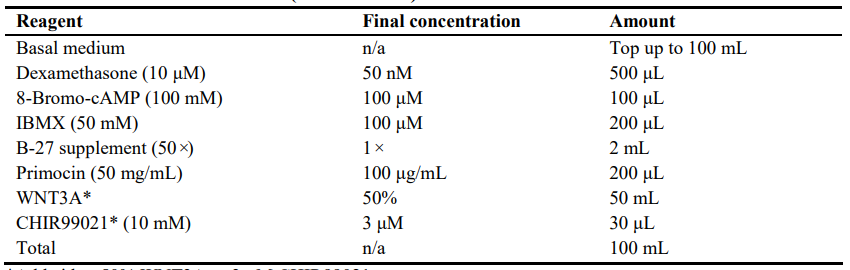
注意:额外添加50% 的WNT3A或3 μM CHIR99021*
4.近端分化培养基(PD培养基)
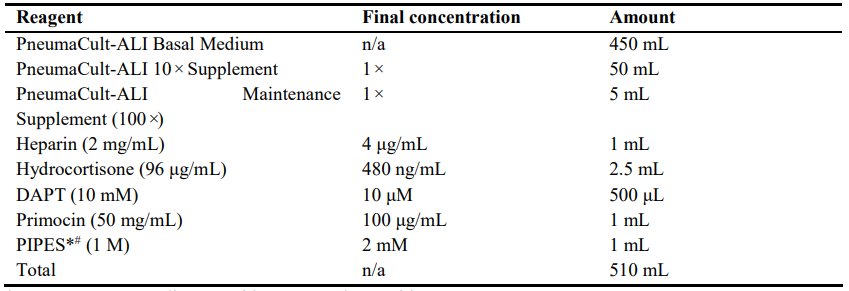
注意:请提前准备两种PD培养基,一种含有PIPES,另一种不含有。 #对于含有PIPES的PD培养基,在加入PIPES后,用盐酸和氢氧化钠调整pH至6.6。*
5.Rspondin1条件培养基
a. 准备选择培养基(500毫升DMEM + 60毫升FBS + 5毫升青霉素-链霉素 + 1.5毫升zeocin选择试剂)。
b. 准备生长培养基(500毫升DMEM + 60毫升FBS + 5毫升青霉素-链霉素)。
c. 在标准细胞培养CO2孵化器中,用选择培养基在T175细胞培养瓶中培养Rspondin1表达的293T细胞,直到它们达到融合。
d. 将细胞分为6个T175细胞培养瓶,用生长培养基培养,直到它们达到融合。
e. 移除生长培养基,并将细胞在50毫升基础培养基(配方1)中培养七天。
f. 收集培养基(即Rspondin1条件培养基)。在300 × g下离心5分钟,沉淀细胞/细胞碎片,并通过0.22微米瓶顶真空过滤器过滤培养基。
g. 将培养基分装成小体积(约50毫升)并存储在-80°C。
6.Noggin条件培养基
a. 准备选择培养基(500毫升DMEM + 60毫升FBS + 5毫升青霉素-链霉素 + 5毫升G418硫酸盐)。
b. 准备生长培养基(500毫升DMEM + 60毫升FBS + 5毫升青霉素-链霉素)。
c. 在标准细胞培养CO2孵化器中,用选择培养基在T175细胞培养瓶中培养表达Noggin的HEK293细胞,直到它们达到融合。
d. 将细胞分为六个T175细胞培养瓶,用生长培养基培养,直到它们达到融合.
e. 移除生长培养基,并将细胞在50毫升基础培养基(配方1)中培养七天。
f. 收集培养基(即Noggin条件培养基)。在300 × g下离心5分钟,沉淀细胞/细胞碎片,并通过0.22微米瓶顶真空过滤器过滤培养基。
g.将培养基分装成小体积(约50毫升)并存储在-80°C。
设备
- SterilGARD e3 Class II Type A2 生物安全柜 (Baker Co, 目录号: SG404-INT)
- Forma Steri-Cycle i160 CO2 165 L 培养箱 (Thermo Fisher Scientific, 目录号: 51030301)
- New Brunswick Innova® 44/44R 可堆叠培养箱振荡器 (Eppendorf, 目录号: M1282-0002)
- 离心机 (Eppendorf, 型号: 5810R)
- FE20-Kit FiveEasy 桌面pH计 (Mettler Toledo, 型号: FE20-KIT)
- LightCycler 96 Instrument (Roche, 目录号: 381711)
- 倒置普通显微镜 (Nikon, 型号: Eclipse TS100)
- 共聚焦显微镜 (Zeiss, 型号: LSM 800)
- 透射电子显微镜 (FEI, 型号: Tecnai G2 20 S-TWIN)
- 细胞分析仪 (BD Biosciences, 型号: FACSCanto II & LSRFortessa)
- Midi Plus 移液控制器 (Sartorius, 型号: 710931)
- Research Plus 机械移液管 (Eppendorf, 目录号: 3123000900)
这些设备是实验室中常用的,包括生物安全柜、培养箱、振荡器、离心机、pH计、荧光定量PCR仪、显微镜、电子显微镜、细胞分析仪和移液控制器等。
试剂:
Nunc 15和50毫升锥形无菌聚丙烯离心管 (Thermo Scientific, 目录号: 339650, 339652)
手术刀片 No. 22 (Swann-Morton, 目录号: 0508)
100毫米 TC处理培养皿 (Corning, 目录号: 430167)
T175细胞培养瓶 (Greiner Bio-One, 目录号: 661175)
Nunc未处理的24孔板 (Thermo Scientific, 目录号: 144530)
Nunclon Sphera 24孔板 (Thermo Scientific, 目录号: 174930)
Costar 6.5和12mm Transwell®,0.4微米孔径的聚酯膜插入物 (Stem Cell Technologies, 目录号: 38024, 38023)
40和100微米细胞过滤器 (Falcon, 目录号: 352340, 352360)
Steritop螺纹瓶顶过滤器 (0.22微米) (Merck Millipore, 目录号: SCGPS01RE)
10/100/1000微升QSP低吸附过滤移液管尖 (Thermo Scientific, 目录号: TFLR102-10-Q, TFLR113-100-Q, TFLR1121000-Q)
5/10/15毫升Stripette血清移液管 (Corning, 目录号: 4487, 4488, 4489)
长约225毫米的巴斯德吸管 (Brand, 目录号: 747720)
5毫升圆底聚苯乙烯试管 (Falcon, 目录号: 352052)
β-BODIPYTM FL C12-HPC (Invitrogen, 目录号: D3792)
LysoTrackerTM 红色DND-99 (Invitrogen, 目录号: L7528)
Matrigel生长因子减少型 (GFR) 基底膜基质,无酚红,无LDEV (Corning, 目录号: 356231)
高级DMEM/F-12 (Gibco, 目录号: 12634010)
DMEM (Gibco, 目录号: 10569010)
ZeocinTM 选择试剂 (100毫克/毫升) (Gibco, 目录号: R25005)
GeneticinTM 选择性抗生素 (G418硫酸盐) (50毫克/毫升) (Gibco, 目录号: 10131035)
HEPES (Gibco, 目录号: 15630056)
GlutaMAX补充剂 (Gibco, 目录号: 35050061)
青霉素-链霉素 (Gibco, 目录号: 15140122)
重组人Rspondin1 (Stem Cell Technologies, 目录号: 78213; Peprotech, 目录号: 120-38)
表达Rspondin1的293T细胞系 (Sigma-Aldrich, 目录号: SCC111)
重组人Noggin (Stem Cell Technologies, 目录号: 78060; Peprotech, 目录号: 120-10C)
B-27补充剂 (50x), 无血清 (Gibco, 目录号: 17504044)
N-乙酰-L-半胱氨酸 (Sigma-Aldrich, 目录号: A9165)
烟酰胺 (Sigma-Aldrich, 目录号: N0636)
Y-27632 二氢氯化物 (Tocris, 目录号: 1254)
A 83-01 (Tocris, 目录号: 2939)
SB 202190 (Sigma-Aldrich, 目录号: S7067)
重组人KGF (FGF-7) (Peprotech, 目录号: 100-19)
重组人FGF-10 (Peprotech, 目录号: 100-26)
重组人heregulin β-1 (Peprotech, 目录号: 100-03)
Primocin (InvivoGen, catalog number: ant-pm-1)
普罗米松 (Tocris, 目录号: 1126)
8-溴-cAMP,钠盐 (Tocris, 目录号: 1140)
IBMX (Tocris, 目录号: 2845)
CHIR 99021 (Tocris, 目录号: 4423)
重组小鼠WNT3A (Peprotech, 目录号: 315-20)
L WNT3A细胞系 (ATCC, 目录号: CRL-2647)
PneumaCult-ALI培养基 (StemCell Technologies, 目录号: 05001)
肝素溶液 (StemCell Technologies, 目录号: 7980)
氢化可的松原液 (StemCell Technologies, 目录号: 7925)
DAPT (Tocris, 目录号: 2634)
PIPES (Sigma-Aldrich, 目录号: P1851)
来自溶组织梭菌的胶原酶 (Sigma-Aldrich, 目录号: C9407)
TrypLE select酶 (10倍), 无酚红 (Gibco, 目录号: A1217701)
磷酸盐缓冲液 (PBS) (Gibco, 目录号: 10010023)
胎牛血清 (FBS), 合格, 热灭活 (Gibco, 目录号: 10082147)
Buffer EL红细胞裂解缓冲液 (Qiagen, 目录号: 79217)
UltraPureTM 0.5 M EDTA, pH 8.0 (Invitrogen, 目录号: 15575020)
甲醛溶液 [即37%多聚甲醛 (PFA)] (Sigma-Aldrich, 目录号: 252549)
曲拉通X-100 (Sigma-Aldrich, 目录号: X100)
牛血清白蛋白 (BSA) (Sigma-Aldrich, 目录号: A9418)
DAPT (Sigma-Aldrich, 目录号: D9542)
鬼笔毒环素 - Atto 647N (Sigma-Aldrich, 目录号: 65906)
ProLongTM玻璃防褪色封片剂 (Invitrogen, 目录号: P36980)
戊二醛 (从香港大学电子显微镜单位购买)
盐酸 (HCl) (Sigma-Aldrich, 目录号: 320331)
氢氧化钠 (NaOH) (Sigma-Aldrich, 目录号: 221465)
基础培养基 (见配方)
扩展培养基 (见配方)
远端分化培养基 (DD培养基) (见配方)
近端分化培养基 (PD培养基) (见配方)
Rspondin1条件培养基 (见配方)
Noggin条件培养基 (见配方)
WNT3A条件培养基 (见配方)
References
- Chiu, M. C., Li, C., Liu, X., Yu, Y., Huang, J., Wan, Z., Xiao, D., Chu, H., Cai, J. P., Zhou, B., et al. (2022). A bipotential organoid model of respiratory epithelium recapitulates high infectivity of SARS-CoV-2 Omicron variant. Cell Discov 8(1): 57.
- Chua, C. W., Shibata, M., Lei, M., Toivanen, R., Barlow, L. J., Bergren, S. K., Badani, K. K., McKiernan, J. M., Benson, M. C., Hibshoosh, H., et al. (2014). Single luminal epithelial progenitors can generate prostate organoids in culture. Nat Cell Biol 16(10): 951-961, 951-954.
- Hu, H., Gehart, H., Artegiani, B., LÖpez-Iglesias, C., Dekkers, F., Basak, O., van Es, J., Chuva de Sousa Lopes, S. M., Begthel, H., Korving, J., et al. (2018). Long-Term Expansion of Functional Mouse and Human Hepatocytes as 3D Organoids. Cell 175(6): 1591-1606 e1519.
- Huch, M., Bonfanti, P., Boj, S. F., Sato, T., Loomans, C. J., van de Wetering, M., Sojoodi, M., Li, V. S., Schuijers, J., Gracanin, A., et al. (2013a). Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. EMBO J 32(20): 2708-2721.
- Huch, M., Dorrell, C., Boj, S. F., van Es, J. H., Li, V. S., van de Wetering, M., Sato, T., Hamer, K., Sasaki, N., Finegold, M. J., et al. (2013b). In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature 494(7436): 247-250.
- Karthaus, W. R., Iaquinta, P. J., Drost, J., Gracanin, A., van Boxtel, R., Wongvipat, J., Dowling, C. M., Gao, D., Begthel, H., Sachs, N., et al. (2014). Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell 159(1): 163-175.
- Lancaster, M. A. and Knoblich, J. A. (2014). Organogenesis in a dish: modeling development and disease using organoid technologies. Science 345(6194): 1247125.
- Li, C., Chiu, M. C., Yu, Y., Liu, X., Xiao, D., Huang, J., Wan, Z. and Zhou, J. (2022). Establishing Human Lung Organoids and Proximal Differentiation to Generate Mature Airway Organoids. J Vis Exp (181).
- Li, M. and Izpisua Belmonte, J. C. (2019). Organoids - Preclinical Models of Human Disease. N Engl J Med 380(6): 569-579.
- Sachs, N., de Ligt, J., Kopper, O., Gogola, E., Bounova, G., Weeber, F., Balgobind, A. V., Wind, K., Gracanin, A., Begthel, H., et al. (2018). A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity. Cell 172(1-2): 373-386 e310.
- Sachs, N., Papaspyropoulos, A., Zomer-van Ommen, D. D., Heo, I., Bottinger, L., Klay, D., Weeber, F., Huelsz-Prince, G., Iakobachvili, N., Amatngalim, G. D., et al. (2019). Long-term expanding human airway organoids for disease modeling. EMBO J 38(4): e100300.
- Sato, T., Stange, D. E., Ferrante, M., Vries, R. G., Van Es, J. H., Van den Brink, S., Van Houdt, W. J., Pronk, A., Van Gorp, J., Siersema, P. D., et al. (2011). Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology 141(5): 1762-1772.
- Sato, T., Vries, R. G., Snippert, H. J., van de Wetering, M., Barker, N., Stange, D. E., van Es, J. H., Abo, A., Kujala, P., Peters, P. J., et al. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459(7244): 262-265.
- Schlaermann, P., Toelle, B., Berger, H., Schmidt, S. C., Glanemann, M., Ordemann, J., Bartfeld, S., Mollenkopf, H. J. and Meyer, T. F. (2016). A novel human gastric primary cell culture system for modelling Helicobacter pylori infection in vitro. Gut 65(2): 202-213.
- Schutgens, F. and Clevers, H. (2020). Human Organoids: Tools for Understanding Biology and Treating Diseases. Annu Rev Pathol 15: 211-234.
- Wroblewski, L. E., Piazuelo, M. B., Chaturvedi, R., Schumacher, M., Aihara, E., Feng, R., Noto, J. M., Delgado, A., Israel, D. A., Zavros, Y., et al. (2015). Helicobacter pylori targets cancer-associated apical-junctional constituents in gastroids and gastric epithelial cells. Gut 64(5): 720-730.
- Zhou, J., Li, C., Sachs, N., Chiu, M. C., Wong, B. H., Chu, H., Poon, V. K., Wang, D., Zhao, X., Wen, L., et al. (2018). Differentiated human airway organoids to assess infectivity of emerging influenza virus. Proc Natl Acad Sci U S A 115(26): 6822-6827.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/10/建立双潜能的人肺类器官培养系统及分化产生成熟的肺泡和气道类器官/
- 版权声明: 转载请注明出处,谢谢。

