小鼠室管膜纤毛干的纯化和免疫染色
作者:KH Kai HaoXZ Xueliang Zhu Xiumin Yan
第一次发布: 2022年07月20日第12卷第14期 DOI: 10.21769/BioProtoc.4467
评审: David PaulYoko BekkuNona Farbehi
简介
纤毛和鞭毛是从大多数真核细胞表面突出的基于微管的毛状细胞器,在细胞运动、左右不对称、胚胎发育和组织稳态中起重要作用。对于孤立的纤毛和鞭毛,在了解纤毛的组成、结构和功能方面取得了很大进展。然而,当前的纤毛/鞭毛分离方法在应用于哺乳动物活动纤毛时在纯化纤毛的完整性或生产力方面存在缺陷。在这里,我们描述了一种新的协议,该操作方法通过水平剪切力和温和的洗涤剂将纤毛轴与小鼠室管膜细胞分离。这种方法能够以高产量和更少的细胞体污染生产几乎完整的纤毛。适用于哺乳动物活动纤毛的免疫染色、嘌呤霉素标记测定和邻近结扎测定。
背景
多种鞭毛/纤毛提取方法已被开发出来,包括pH冲击、钙冲击、dibucaine处理以及剥离和滑移等机械方法(Witman等人,1972、1978、1986;Adoutte等人,1980;Mitchell等人,2009)。最初,pH和钙冲击方法是为了从衣藻和四膜虫中提取纤毛而设计的(Gibbons,1965;Rosenbaum和Child,1967)。后来,这两种方法成为原生动物中最常用的鞭毛/纤毛提取方法。在哺乳动物中,剥离或滑移法被用来从培养的细胞中提取初级纤毛,例如MDCK(Madin-Darby犬肾)细胞、正常小鼠胆管上皮细胞(NMCs)和正常大鼠胆管上皮细胞(NRCs)(Huang等人,2006;Kiesel等人,2020)。
钙冲击法结合机械振荡,用于从兔输卵管、猪气管和初级培养的小鼠室管膜细胞(mEPCs)中提取运动纤毛(Anderson,1974;Hastie等人,1986;Zheng等人,2019)。这种方法还用于从大鼠嗅觉纤毛和内髓质集合管(IMCD3)细胞中提取初级纤毛(Mayer等人,2008;Ishikawa等人,2012)。使用这些方法在提取的鞭毛/纤毛中已经很好地研究了构成纤毛的蛋白质种类和比例以及高分辨率的纤毛超微结构。 然而,这些程序通常会导致纤毛膜损伤并忽略分离纤毛的生理活性,从而限制了对纤毛生物学的深入研究。
在此,我们报告了一种改良自钙冲击结合机械振荡法的纤毛分离方案。为了保持分离纤毛的结构和功能完整性并减少细胞质污染,我们在去纤毛缓冲液中降低了洗涤剂的浓度,并使用水平剪切力替代了涡流振荡。通过这种方法,我们获得了足够数量的运动纤毛,用于免疫染色、嘌呤霉素标记和邻近连接试验。作为应用实例,我们应用此程序纯化小鼠室管膜纤毛,以证实纤毛RNA的局部翻译。此外,这种方法也适用于纯化小鼠大脑侧脑室的运动纤毛。
材料和试剂
\1. 0.22 微米_ 过滤器(Millipore,目录号: SLGPR33RB )
\2. 75 cm 2烧瓶(Corning,目录号:430641)
\3. 15 mL管(Falcon,目录号:352095)
\4. 12毫米直径的圆形盖玻片( Marienfeld ,目录号:MAR0111520)
\5. 载玻片(Premiere,目录号:9308W )
\6. 24孔板(Costar,目录号:3524)
\7. 15厘米培养皿(Corning,目录号:430599)
\8. 滤纸( GE,目录号:10311611 )
\9. 封口膜(Bemis,目录号:PM-996)
\10. Milli-Q 水
\11. 纤连蛋白(1 mg / mL)( Sigma-Aldrich,目录号:FC010),储存在4 °C
\12. LS003126 ),4°C 储存
\13. DMEM( ThermoFisher Scientific , Gibco TM ,目录号: 12430054),储存于 4°C
\14. Primocin (50 mg/mL) ( InvivoGen , ant-pm-2),储存于-20°C
\15. 胎牛血清( Ausbian ,VS500T),- 20°C储存
\16. 聚-L-赖氨酸氢溴酸盐( Sigma-Aldrich ,目录号:P1399 ) ,将粉末储存在-20°C 。
μm过滤器对储备溶液(Milli-Q 水中的 100 mg/mL 聚-L-赖氨酸)进行灭菌,并将其分装在 -20°C 下储存。
\17. Trition X-100 ( Sangon Biotech ,目录号:A110694 )
\18. Tween 20( Sangon Biotech,目录号:A100777)
\19. 多聚甲醛(PFA)(Sigma-Aldrich,目录号:P6148),将粉末储存在4 °C
\20. 牛血清白蛋白(BSA)( Sigm a-Aldrich,目录号:A3912 ),将粉末储存在4°C
\21. 小鼠抗乙酰化微管蛋白(Sigma-Aldrich,目录号:T6793),4°C保存
\22. 兔抗 Cep290(自制) (Zhao et al. ,2021) ,- 20°C保存
\23. 豚鼠抗Odf2(自制) (Zhao et al. , 2019) ,-20°C 保存
\24. ThermoFisher Scientific,目录号:A-21202 )缀合的驴抗小鼠IgG ,-80°C长期储存,4°C短期储存
\25. 与Cy3缀合的驴抗兔Ig G( Jackson ImmunoResearch ,目录号: 711-165-152 ),-80°C长期储存,4°C短期储存
\26. ImmunoResearch ,目录号:706-605-148)缀合的驴抗豚鼠IgG ,-80°C长期储存,4°C短期储存
\27. ProLong Diamond Antifade Mountant ( ThermoFisher Scientific,目录号:P36970),4°C储存
\28. 浸油(Le cia microsystem,目录号:12847995 )
\29. PBS (见食谱),储存在 4°C
\30. D issection 缓冲液(参见配方), 4°C储存
\31. 酶消化缓冲液(见材料试剂) ,新鲜制备
\32. mEPC培养基(见配方),4°C 储存
\33. 饥饿培养基(见材料试剂),储存在 4°C
\34. 脱纤缓冲液(见配方),储存在 4°C
\35. 4% PFA (见材料试剂)
\36. TBST (10 × ) (见材料试剂)
\37. 封闭缓冲液(参见配方) ,分装于 -20°C 储存
设备
\1. Milli-Q(Millipore,型号:Advantage A10)
\2. 锋利的镊子( Dumont,目录号: 0208-5/45-PO)
\3. 镊子(Dumont,目录号:0203-5/15-PO)
\4. 卧式振动筛(智初,型号: ZQZY -AS9 )
\5. 高速离心机( ThermoFisher Scientific,型号: Sorvall LYNX 6000,目录号:75006590)
\6. S翼桶转子( ThermoFisher Scientific,型号: BIOFlex TM HC ,目录号: 75003000 )
\7. 共聚焦显微镜(徕卡,型号:TCS SP8 WLL 系统,配备 63×/1.4 油浸物镜)
程序步骤
A. 睫状轴净化前的准备工作
75 cm^2中培养和维持小鼠室管膜细胞 ( mEPCs ) 烧瓶 (hao等人,2021 ) 。
a. 添加 6 mL纤连蛋白( PBS 中10 μg / mL )至75 cm^2 培养瓶,在培养前一天在 37°C 孵育 24 小时以包被培养瓶。
b. 在冰冷的解剖缓冲液中解剖五只 C57BL/6 小鼠幼崽的端脑,并用锋利的镊子去除海马、小脑、脉络丛、嗅球和脑膜。
c. 将解剖的端脑转移到 15 mL 管中,用 10 mL 新鲜制备的酶消化缓冲液在 37°C 下消化 30 分钟。
d. 用 5 mL 移液器吹打 10 次,小心分离细胞,然后在 400 ×g 在室温离心5分钟。
e. mEPC培养基重悬细胞,并将它们移植到75 平方厘米纤连蛋白涂层烧瓶中。
f. 播种后一天摇晃并去除神经元。
g. 当细胞汇合时,用 PBS 冲洗细胞,并加入10 mL 饥饿培养基以诱导分化。
h. 在饥饿培养基中培养十天后收获细胞。
注意:在血清饥饿的第 10 天收获时,多纤毛细胞的比例应约为 50%(图 1)
图 1. 原代培养的小鼠室管膜细胞。
乙酰化微管蛋白 ( Ac-tub) 修饰纤毛轴丝。 Zo-1 和 DAPI 分别标记紧密连接和细胞核。 比例尺,25 μ m在纤毛纯化前一天用 多聚-L-赖氨酸涂上盖玻片。
a. 将 12 个灭菌盖玻片放入 24 孔板中,每孔一个盖玻片。
b. 冲洗盖玻片3 次,用500 每孔微升PBS 。
c. 加入 500 μL聚-L-赖氨酸(100 ng / μL ) 加入每孔, 37°C 孵育 24 h 。
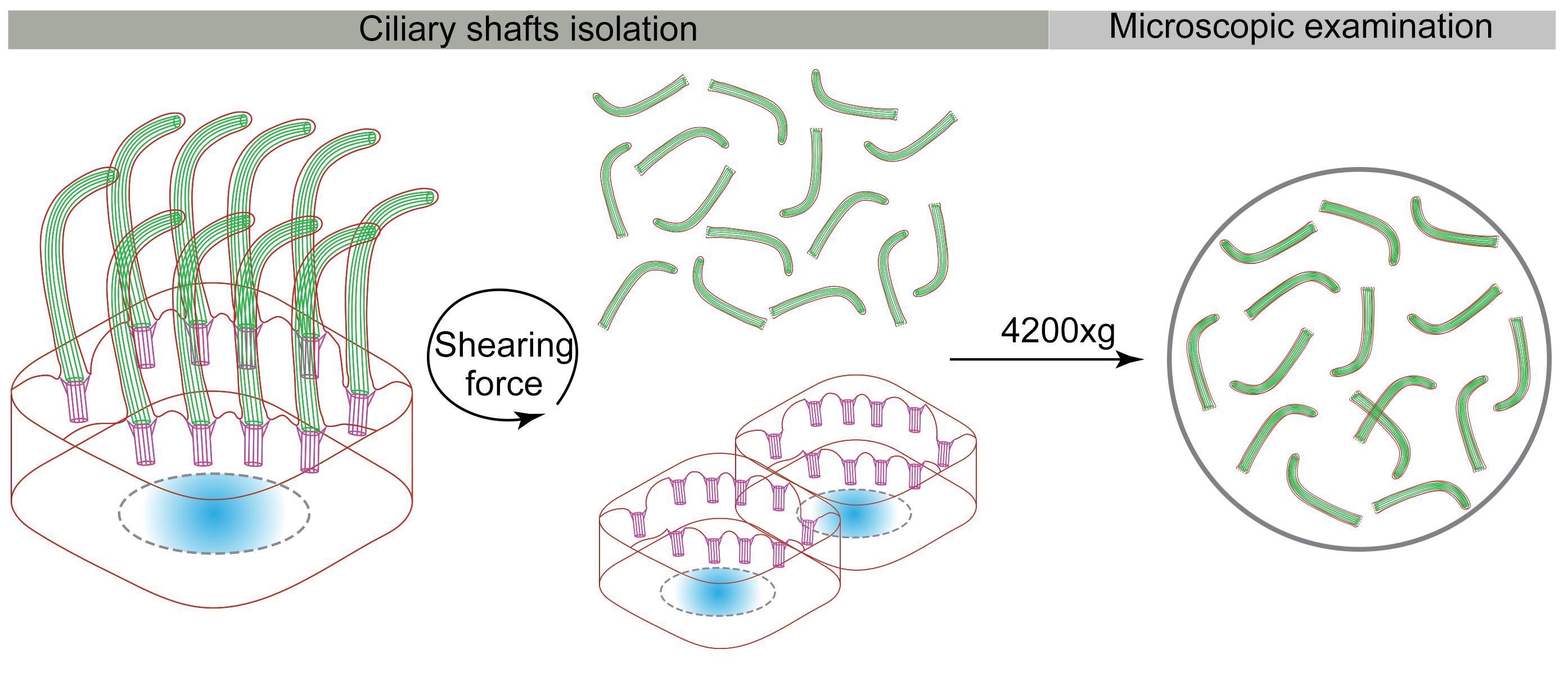
B. 纤毛细胞净化
清洗mEPC 两次用 6 mL 冰冷的 PBS,两次用 6 mL 冰冷的脱纤缓冲液快速。
在烧瓶中,加入 9 m L 的含有 0.01% Triton X-100 的冰冷deciliation 缓冲液。
将烧瓶固定在带有粘性绿色橡胶底座的水平振动筛上(图 2)。

图 2. 水平振动筛上粘附烧瓶的代表性图像。
立即在 3 00 rpm 和 37°C 下摇动15 分钟,以从过渡区底部分离纤毛(视频 1)
视频1.使用剪切力净化睫状轴。
纤毛干的上清液转移到15 mL试管中。
在摆动斗式转子中水平离心机( BIOFlex TM HC)在600 × g和 4 °C 10 分钟以去除细胞碎片。
用 500 μL的 PBS冲洗聚 L-赖氨酸涂层盖玻片三次。
将上清液分装到 12 孔板中,用等量的聚 L-赖氨酸涂层盖玻片(每孔 720 μL上清液)。
将 24 孔板放入摆动桶转子中 ( BIOFlex TM HC) .
离心机 4,200 × g水平 和 4°C 10 分钟。
洗盖玻片_ 每孔500 μL PBS 一次。
现在,纯化的纤毛细胞已准备好进行免疫染色、嘌呤霉素标记和邻近结扎测定。
注意:建议使用免疫荧光染色来检查纤毛的质量和完整性。针对 Arl13b(一种室管膜细胞膜蛋白)和乙酰化微管蛋白的抗体分别用于睫状膜和轴丝的质量和完整性。针对 Cep290(一种过渡区蛋白)和 Odf2(一种基体蛋白)的抗体用于检查纯化的睫状轴是否含有过渡区和缺乏基体。
C. 纯化的睫状轴的免疫染色
室温下用每孔500 μL的 4% PFA固定室管膜纤毛细胞15 分钟。
每孔 500 μL PBS 短暂洗涤 。
使用 500 μL的 0.5% Triton X-100 渗透 15 分钟。
每孔 500 μL PBS 短暂洗涤。
用 500 μL 封闭缓冲液孵育 (TBST 中 4% BSA)在室温下每孔1 小时。
制作一个湿度室(图 3)。

图 3. 湿度室的代表性图像。
注意锡箔纸、滤纸、封口膜和盖玻片。滤纸和封口膜分别由紫色和蓝色虚线勾勒。a. 用锡箔包裹15 厘米培养皿的外表面,以保护样品免受光照。将锡纸的亮面朝湿度室外面放置。
b. 将浸水的滤纸放入培养皿中。
c. 将一块封口膜放在滤纸上。使用镊子将盖玻片转移到封口膜上。将有纤毛细胞的一侧朝上。
用 90 μL封闭缓冲液中的稀释一抗孵育每个盖玻片 , 在 4°C 过夜。
用 200 μL封闭缓冲液洗涤 3 次,每次 5 分钟。
封闭缓冲液中稀释的二级抗体,得到90μL,然后在室温下孵育每个盖玻片1 小时。
用 200 μL封闭缓冲液洗涤 3 次,每次 5 分钟。
200μL短暂洗涤每个盖玻片的 Milli-Q 水。
每张片子滴 10 μL 封固剂( ProLong 钻石防褪色封固剂,封片) 。
用滤纸从盖玻片中去除多余的 Milli-Q 水。
立即将盖玻片安装到载玻片上( Cao等人,2014 年) 。
将样品在室温下避光干燥至少 2 小时,然后将其储存在4°C。
D. 共聚焦显微镜对纯化睫状轴的成像
共聚焦显微镜图像是在具有 63×/1.4 油浸物镜的 Leica TCS SP8 WLL 系统上拍摄的。使用折射率为 1.518 的浸油来最大限度地减少球面像差。扫描速度为 400 Hz ,线平均为 3,沿z 轴以 0.5-μm 的间隔捕获光学切片。典型图像如图 4 所示。对于额外的荧光图像,请参阅原始研究文章的补充图 2C ( Hao et al. , 2021 ) 。
测量参数见表 1,荧光成像的适当睫状轴密度如图 4 所示。
表 1. 滤波器和测量参数
**Table 1. Filters and measurements parameters
**Filter Excitation Emission Laser (nm) Intensity Detector Wavelength (nm) Gain Alexa Fluor 488 498 1.5% HyD standard mode 508–542 81% Cy3 550 7% HyD standard mode 560–620 100% Alexa Fluor 647 650 2% HyD standard mode 660–720 80% 
图 4。孤立的睫状轴的典型图像。
从一个纯化的睫状轴 将75 cm 2 mPEC烧瓶均匀地旋转到 12 片 12-mm 盖玻片上。 Ac-tub 装饰纤毛轴丝。 Cep290 标志着过渡区。比例尺,25 μ m 。
材料试剂
PBS, pH 7.4
Reagent Final concentration Amount NaCl 137 mM 8 g KCl 2.7 mM 0.2 g KH2PO4 2 mM 0.24 g Na2HPO4 10 mM 1.44 g Milli-Q water n/a 1,000 mL Total n/a 1,000 mL mEPC culture medium
Reagent Final concentration Amount Primocin 50 μg/mL 500 μL DMEM n/a 500 mL FBS 10% 50 mL Total n/a 500 mL Starvation culture medium
Reagent Final concentration Amount Primocin 50 μg/mL 500 μL DMEM n/a 500 mL Total n/a 500 mL Dissection buffer, pH 7.4
Reagent Final concentration Amount NaCl 161 mM 9.4 g KCl 5 mM 0.37 g MgSO4 1 mM 0.12 g CaCl2 4.7 mM 0.41 g HEPES 5 mM 1.2 g Glucose 5.5 mM 0.99 g Milli-Q water n/a 1,000 mL T0tal n/a 1,000 mL Enzymatic digestion buffer
Reagent Final concentration Amount EDTA (50mM stock) 0.5 mM 100 μL CaCl2 (100mM stock) 1 mM 100 μL NaOH (1M stock) 1.5 mM 15 μL Papain 10 U/mL 100 U Dissection buffer n/a 10 mL Total n/a 10 mL Deciliation buffer, pH 5.5
Reagent Final concentration Amount Sucrose 250 mM 85.575 g CaCl2 20 mM 2.22 g Pipes 20 mM 6.047 g Milli-Q water n/a 1,000 mL Total n/a 1,000 mL Adjust the pH with saturated HCl. Filter-sterilize with a 0.22 μm filter, and store at 4°C.
4% PFA
Reagent Final concentration Amount Paraformaldehyde 4% 4 g PBS n/a 100 mL Total n/a 100 mL Heat the solution to 60°C with stirring, to accelerate the dissolution of PFA.
Freshly prepare, and filter-sterilize with a 0.22 μm filter before use.
TBST (10×), pH 7.5
Reagent Final concentration Amount NaCl 1.5 M 88 g Tris base 0.5 M 60 g Tween 20 0.5% 5 mL Milli-Q water n/a 1,000 mL Total n/a 1,000 mL Heat the solution to 60°C with stirring, to accelerate the dissolution of solutes.
Blocking buffer
Reagent Final concentration Amount BSA 4% 4 g TBST (10×) 1× 10 mL Milli-Q wate n/a 90 mL Total n/a 100 mL Filter-sterilize with a 0.22 μm filter, and store at -20°C.
References
- Adoutte, A., Ramanathan, R., Lewis, R. M., Dute, R. R., Ling, K. Y., Kung, C. and Nelson, D. L. (1980). Biochemical studies of the excitable membrane of Paramecium tetraurelia. III. Proteins of cilia and ciliary membranes. J Cell Biol 84(3): 717-738.
- Anderson, R. G. (1974). Isolation of ciliated or unciliated basal bodies from the rabbit oviduct. J Cell Biol 60(2): 393-404.
- Cao, J., Zhu, X. and Yan, X. (2014). Fluorescence Microscopy for Cilia in Cultured Cells and Zebrafish Embryos. Bio-protocol 4(14): e1188.
- Gibbons, I. R. (1965). Chemical dissection of cilia. Arch Biol (Liege) 76(2): 317-352.
- Hao, K., Chen, Y., Yan, X. and Zhu, X. (2021). Cilia locally synthesize proteins to sustain their ultrastructure and functions. Nat Commun 12(1): 6971.
- Hastie, A. T., Dicker, D. T., Hingley, S. T., Kueppers, F., Higgins, M. L. and Weinbaum, G. (1986). Isolation of cilia from porcine tracheal epithelium and extraction of dynein arms. Cell Motil Cytoskeleton 6(1): 25-34.
- Huang, B. Q., Masyuk, T. V., Muff, M. A., Tietz, P. S., Masyuk, A. I. and Larusso, N. F. (2006). Isolation and characterization of cholangiocyte primary cilia. Am J Physiol Gastrointest Liver Physiol 291(3): G500-509.
- Ishikawa, H., Thompson, J., Yates, J. R., 3rd and Marshall, W. F. (2012). Proteomic analysis of mammalian primary cilia. Curr Biol 22(5): 414-419.
- Kiesel, P., Alvarez Viar, G., Tsoy, N., Maraspini, R., Gorilak, P., Varga, V., Honigmann, A. and Pigino, G. (2020). The molecular structure of mammalian primary cilia revealed by cryo-electron tomography. Nat Struct Mol Biol 27(12): 1115-1124.
- Mayer, U., Ungerer, N., Klimmeck, D., Warnken, U., Schnolzer, M., Frings, S. and Mohrlen, F. (2008). Proteomic analysis of a membrane preparation from rat olfactory sensory cilia. Chem Senses 33(2): 145-162.
- Mitchell, K. A., Szabo, G. and Otero Ade, S. (2009). Methods for the isolation of sensory and primary cilia–an overview. Methods Cell Biol 94: 87-101.
- Rosenbaum, J. L. and Child, F. M. (1967). Flagellar regeneration in protozoan flagellates. J Cell Biol 34(1): 345-364.
- Witman, G. B. (1986). Isolation of Chlamydomonas flagella and flagellar axonemes. Methods Enzymol 134: 280-290.
- Witman, G. B., Carlson, K., Berliner, J. and Rosenbaum, J. L. (1972). Chlamydomonas flagella. I. Isolation and electrophoretic analysis of microtubules, matrix, membranes, and mastigonemes. J Cell Biol 54(3): 507-539.
- Witman, G. B., Plummer, J. and Sander, G. (1978). Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. J Cell Biol 76(3): 729-747.
- Zhao, H., Chen, Q., Fang, C., Huang, Q., Zhou, J., Yan, X. and Zhu, X. (2019). Parental centrioles are dispensable for deuterosome formation and function during basal body amplification. EMBO Rep 20(4).
- Zhao, H., Chen, Q., Li, F., Cui, L., Xie, L., Huang, Q., Liang, X., Zhou, J., Yan, X. and Zhu, X. (2021). Fibrogranular materials function as organizers to ensure the fidelity of multiciliary assembly. Nat Commun 12(1): 1273.
- Zheng, J., Liu, H., Zhu, L., Chen, Y., Zhao, H., Zhang, W., Li, F., Xie, L., Yan, X. and Zhu, X. (2019). Microtubule-bundling protein Spef1 enables mammalian ciliary central apparatus formation. J Mol Cell Biol 11(1): 67-77.
- 本文作者: Anderson
- 本文链接: http://nikolahuang.github.io/2024/03/09/小鼠室管膜纤毛干的纯化和免疫染色/
- 版权声明: 转载请注明出处,谢谢。

